 Les numéros 40, 42, 43 et 46 d’Actuailes, ont expliqué que l’ONU a adopté des "Objectifs de développement durable" (ODD) pour les années 2015-2030 évoquant des "limites planétaires », et la nécessité de "stabiliser la population mondiale d’ici le mi-siècle".
Les numéros 40, 42, 43 et 46 d’Actuailes, ont expliqué que l’ONU a adopté des "Objectifs de développement durable" (ODD) pour les années 2015-2030 évoquant des "limites planétaires », et la nécessité de "stabiliser la population mondiale d’ici le mi-siècle".
Y a-t-il des limites à l’acidification des océans ? La revue « Nature » a publié le 16 mars 2016, une étude montrant d’impact sur les récifs de coraux. Est-ce vrai ?
Analyse publiée dans "Actuailes n°51"
De quoi s'agit-il ?
Qu’appelle-t-on acidité ?
Faisons un petit peu de chimie : dans tout élément de matière, qu'on appelle des atomes, un certain nombre d'électrons tournent autour d’un noyau sur des orbites concentriques. Seuls deux électrons peuvent circuler sur la première orbite, 8 sur la seconde, etc...
Mais certains atomes de matière n’ont pas assez d’électrons sur leur orbite extérieure. Ainsi il manque un ou deux électrons à l’oxygène ou au chlore. A l’inverse, l’hydrogène ou le sodium en ont un en trop.
Pour devenir stables, les atomes qui en ont en trop, ont tendance à se lier à ceux à qui il en manque. C’est ainsi qu’un atome de sodium (Na) et un atome de chlore (Cl) donnent une molécule de chlorure de sodium, le sel de table, ou bien, deux atomes d’oxygène (O2) et un atome de carbone (C), pour donner le gaz carbonique que nous respirons.
Lorsque ces molécules se dissolvent dans l’eau, leurs liaisons se distendent. Les molécules se transforment en "radicaux" instables. Les uns ont perdu des électrons, laissant alors ce qu’on appelle un ion positif (ou cation), par exemple le Na+ ou le H+. A l’inverse, d’autres "radicaux" en ont capté; on les appelle des ions négatifs (ou anion), par exemple Cl- ou OH-
Tous ces ions s’attirent ou se repoussent dans un mouvement incroyable. Quand un liquide a un excès d’ions H+, il est acide, par exemple dans un vinaigre, ou alcalin dans le cas contraire. par exemple dans un liquide savonneux.
Comment se développent les coraux dans les océans ?
Dans les océans, le gaz carbonique (CO2) se dissout dans l’eau (H2O), se dissocie en radicaux HCO3- et H+. Il acidifierait l’océan. Au contraire, une terre contenant du calcium sous forme de sels de calcium aura tendance à attirer des électrons.
La vie peut se développer dans des milieux très acides, par exemple les bactéries de notre estomac. Généralement, les plantes préfèrent les sols acides que les sols très alcalins. Le développement des coraux est très complexe et Wikipedia dit bien que "les effets de l'acidification des océans sont encore mal compris".
Y-aurait-il des limites en matière d’acidification des océans?
Une étude, reconnue par l’ONU, parue le 15 janvier 2015 dans Sciences Express et dénommée "Les limites planétaires", se contente de dire que l’acidité aurait "augmenté d’environ 30% au cours des 200 dernières années, à cause de l'augmentation du CO2 atmosphérique". Elle prétend que le problème serait réglé "si la limite de changement climatique de 350 ppm CO2 était respectée" par une réduction de consommation humaines de combustibles. Mais elle ajoute en même temps : "aucune nouvelle preuve n’a émergé pour suggérer que la limite proposée devrait être ajustée" et que "l'hétérogénéité géographique est importante pour suivre la nature de limites pour les océans du monde". On a le sentiment d’affirmations peu fondées !
Les causes naturelles de variation d’acidité
Les océans ont une acidité résultant de la présence dans l’eau d’éléments ioniques multiples. Les anions (chlore, sodium, sulfates), viennent essentiellement de l’intérieur des terres. Les cations (Magnésium, Calcium, potassium ou autres) viennent surtout de la surface du sol. Les rivières transportent les ions dissous vers l'océan. Il n’y a donc pas que le CO2 qui joue sur l’acidité de l’océan.
Par ailleurs, la craie qui s’accumule dans le fond des océans est un mécanisme de rétroaction qui concentre les excédents d’ions carbonates synthétisés par des êtres vivants. On en a un exemple dans le bassin parisien lorsqu’il était sous les océans et on devine les milliards de tonnes que cela représente en visitant les carrières de craie près de Paris.
Enfin, il existe ce qu’on appelle des "effets tampons". En chimie, ce mécanisme explique comment une solution conserve la même acidité malgré l'addition de petites quantités d'un acide. C’est ce qui fait dire à un chercheur, R.A. Feely, que "à l’échelle de temps intéressant l’humanité, ce processus n'est pas assez rapide pour atténuer de manière significative l'acidification des océans".
Que conclure ?
Les mêmes questions se posent que sur le climat, les engrais, les particules fines, ou le trou d’ozone : les "neuf dimensions critiques" dont parle l’ONU sont-elles des limites fondées scientifiquement ? Ou bien ces "limites planétaires" sont-elles un prétexte à justifier une "stabilisation de la population mondiale" par des moyens peu moraux ?
Pour aller plus loin...
a) Comment mesure-t-on l'acidité d'un océan?
On a expliqué dans l'article d'Actuailes que "quand un liquide a un excès d’ions H+, il est acide".
C'est pourquoi on utilise un indice qui s'appelle le pH, c'est à dire le "potentiel Hydrogène". C'est un indice qui varie entre 0 et 14. Un pH=7 est "neutre". Un milieu est acide quand son pH est inférieur à 7 et alcalin si son pH est supérieur. Les océans, contrairement à ce qu'on imagine, sont des alcalins puisque leur pH est d'environ 8,2. C'est donc une question de langage de parler d'acidification pour évoquer une simple variation de pH.
Le pH océanique, est d'une homogénéité médiocre. Il est relativement complexe à mesurer. C'est pourquoi on ne connait les valeurs de pH océaniques que depuis relativement peu de temps, et en moins d'endroits que les températures océaniques superficielle. Par ailleurs, il n'existe pas, à notre connaissance, d'un indice global: on ne peut donc parler que de valeurs locales. C'est pourquoi il est très risqué de de présenter des courbes comme celle-ci d'évolution du pH depuis des millions d'années. On risque d'en tirer des conclusions très fausses.
b) Comment le corail fabrique-il sa carapace de calcaire ?
Le corail est un animal.
Il vit en colonie dans la mer. Il est de la même famille que les méduses. Il a une bouche avec laquelle il se nourrit de bactéries qui vivent dans la mer qu'on appelle globalement le plancton. ils ont des sortes de pieds, qu'on appelle des pédicules avec lesquels ils se fixent sur un rocher. ils ont aussi un squelette, mais contrairement à d'autres animaux qui ont un squelette intérieur, les coraux fabriquent leur squelette à l'extérieur. Les coraux ont une sorte de peau qu'on appelle l'endoderme qui secrète une sorte de gélatine dans laquelle vivent des cellules qu'on appelle les "scleroblastes" qui vont fabriquer le squelette de calcaire.
Certains coraux ne peuvent vivre qu'en association avec une toute petite algue.
On appelle cette algue d'un nom compliqué, une "zooxanthelle". Elle ne peut vivre sans le corail et le corail ne peut vivre sans l'algue. On appelle cela une "symbiose". Comment cela?
- le corail a besoin, pour se nourrir, de sucres qu'on appelle des glucides. Or l'algue peut le fabriquer avec le mécanisme de la photosynthèse qu'on rencontre dans toutes les plantes.
- Réciproquement, l'algue a besoin du corail pour se protéger. Elle se nourrit aussi de déchets produits par le corail.
La construction du squelette de calcaire du corail: un mécanisme compliqué.
Pour comprendre il faut revenir à notre explication sur ce que sont les anions et les cations. Le calcium est dans la mer sous forme ionique: Ca++. Cet ion est mélangé, dans l'eau de mer, avec d'autres ions venant de la dissolution du CO2 dans l'eau, les ions H+ et CO3--. (la formule s'écrit: CO2 + H2O → 2H+ + CO3--). Ces ions sont ceux d'un sel qu'on appelle le bicarbonate de calcium: ca++ et 2HCO3-. (la formule s'écrit: Ca++ + 2 CO3-- + 2H+ → Ca(HCO3)2). Ce bicarbonate est soluble dans l'eau de mer. Il faut l'intervention d'un être vivant pour lui donner une structure stable moléculaire de calcaire, le CaCO3. Ce calcaire n'est pas soluble dans l'eau. Cela donne les récifs coralliens.
Comment le corail est-il capable de transformer un bicarbonate en monocarbonate? C'est le rôle des petites cellules dont on a parlé, les "scleroblastes". Ces cellules se nourrissent dans la sorte de gélatine dont on a parlé qui porte le nom savant de ECF (Extracytoplasmic Calcifying Fluid). C'est à ce niveau que les ions HCO3- et Ca++ s’associent et cristallisent sous forme d’aiguilles calciques. C'est un mécanisme très complexe encore mal connu. Tu peux demander à Papa de lire une thèse de doctorat à ce sujet, écrite par Julien Vimal (2007) « Physiopathologie des Coraux ». Elle explique comment l'ion calcium pourrait être transporté à l'intérieur des cellules du corail. Elle fait état d'une hypothèse selon laquelle le CO2 nécessaire viendrait de la respiration du corail. Les algues vivant en symbiose avec le corail jouerait un rôle: par la photosynthèse, l'algue absorberait le gaz carbonique contenu dans le corail et par conséquent déplace l’équilibre des réactions ioniques dont nous avons parlé. Ceci favoriserait donc la dissociation de l’acide carbonique et ainsi, le dépôt de carbonate de calcium. Les algues zooxanthelles pourraient aussi secréter des vitamines qui augmenteraient le rendement des cellules scleroblastes. Elles élimineraient aussi certains déchets du corail à base d'ion ammonium qui gêneraient la calcification.
Tout cela est assez mal connu et, tant qu'on ne connait pas les mécanismes exacts, il est difficile de dire que l'acidification des océans est nuisible aux coraux.
Pour approfondir...
Quelle est la différence entre un atome et un ion?
Qu'est-ce qu'une "charge électrique"?
Pour bien imaginer la différence, il faut comprendre ce qu'est une charge électrique. C'est une notion abstraite, comparable à celle de masse. Quand on parle de masse, on devine que c'est la masse d'une pierre qui la fait tomber au sol. Pourtant on est incapable de dessiner une masse ou de la représenter. Le concept de masse permet pourtant de comprendre le mouvement de la pierre quand elle tombe.
Or la matière est faite de toute petite particule de matière qui sont chargées électriquement. Ce concept de charge électrique, lui aussi, est un concept abstrait qui va permettre de comprendre pourquoi des petites particules s'attirent et d'autres se repoussent. Contrairement à la masse, la charge électrique peut prendre deux formes, que l'expérience amène à considérer comme « opposées » ; on les qualifie arbitrairement de positive et négative. Deux charges de même nature, deux charges positives par exemple, se repoussent. On les appelle des protons. Au contraire, deux charges de nature opposée s'attirent: l'une positive (un proton) et l'autre positive (un électron). Il existe une troisième catégorie de particule qu'on appelle neutron parce qu'elle ne sont attirées par aucune autre . On convient donc qu'ils n'ont pas de charge électrique.
Qu'est-ce qu'un atome?
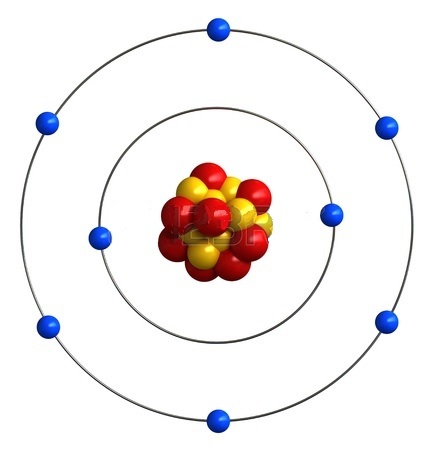 Il faut faire un peu de chimie: La matière est constituée d'atomes qui ont tous la même structure. Par exemple l'oxygène a un noyau constitué de 8 neutrons (en jaune), 8 protons (en rouge). Sur des orbites autour du noyau, 8 électrons sont attirés par les protons. Cette force électrique a provoque un mouvement circulaire des électrons autour du noyau, un peu comme la force de qui pèse sur la masse de la terre la fait tourner autour du soleil. Un atome a, généralement, autant de protons que d'électrons.
Il faut faire un peu de chimie: La matière est constituée d'atomes qui ont tous la même structure. Par exemple l'oxygène a un noyau constitué de 8 neutrons (en jaune), 8 protons (en rouge). Sur des orbites autour du noyau, 8 électrons sont attirés par les protons. Cette force électrique a provoque un mouvement circulaire des électrons autour du noyau, un peu comme la force de qui pèse sur la masse de la terre la fait tourner autour du soleil. Un atome a, généralement, autant de protons que d'électrons.
Les différents types d'atomes et leurs liaisons en eux: les molécules
Pour entrer plus dans le détail des orbites d'électrons, on constate, par exemple, que l'atome d'hydrogène a un électron sur son orbite extérieure. C'est une orbite très petite et il n'y a de la place que pour deux électrons.
Quand un verre est à moitié vide, on peut aussi dire qu'il est à moitié plein. L'électron de l'hydrogène est comparable. On peut dire que l'hydrogène a un électron en trop ou bien qu'il lui en manque un.
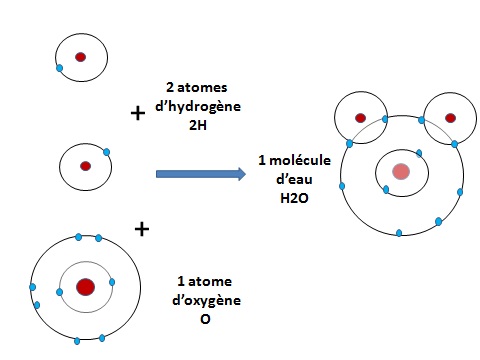 Si on considère qu'il lui en manque un, il va donc chercher à mettre en commun un second électron en se liant à un atome qui en a un en trop. Il peut ainsi se lier avec un autre atome d'hydrogène pour donner la molécule d'hydrogène H2.
Si on considère qu'il lui en manque un, il va donc chercher à mettre en commun un second électron en se liant à un atome qui en a un en trop. Il peut ainsi se lier avec un autre atome d'hydrogène pour donner la molécule d'hydrogène H2.
Si on considère qu'il en a un en trop, il va au contraire se lier à un atome à qui il en manque. Par exemple deux atomes d'hydrogène vont se lier à un atome d'oxygène pour donner une molécule d'eau. En effet l'atome d'oxygène a 6 électrons sur son orbite extérieure, la seconde, où il y de la place pour 8 électrons.
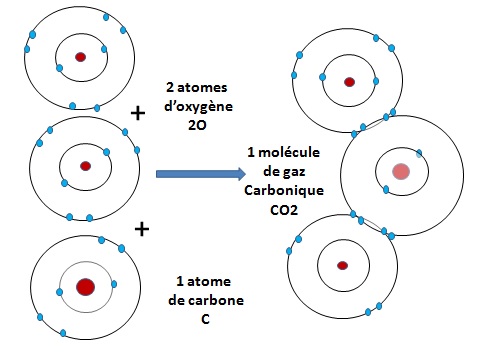 - Prenons l'exemple du gaz carbonique. Le carbone a 4 électrons sur son orbite périphérique. Il peut en mettre quatre autres en commun avec ceux de deux atomes d'oxygène. On voit sur le second schéma qu'il y a ainsi 8 électrons sur chacune des trois orbites extérieures.
- Prenons l'exemple du gaz carbonique. Le carbone a 4 électrons sur son orbite périphérique. Il peut en mettre quatre autres en commun avec ceux de deux atomes d'oxygène. On voit sur le second schéma qu'il y a ainsi 8 électrons sur chacune des trois orbites extérieures.
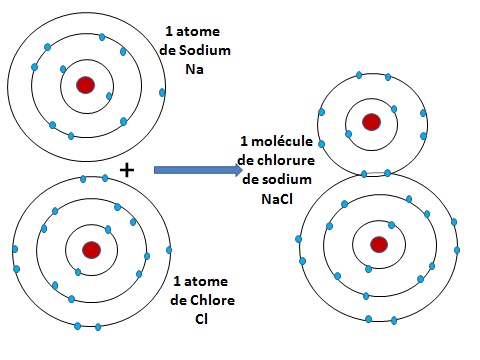 - Prenons maintenant l'exemple d'atomes encore plus gros: le chlore et le sodium.
- Prenons maintenant l'exemple d'atomes encore plus gros: le chlore et le sodium.
On voit sur le troisième schéma que le chlore a 7 électrons sur son orbite périphérique, la troisième. Or la troisième, comme la seconde peut en recevoir 8. Il lui en maque un.
Or l'atome de sodium n'a qu'un électron sur sa troisième orbite.
Les atomes de sodium et de chlore vont se lier pour donner une molécule qu'on appelle le chlorure de sodium. C'est le sel de table que nous mangeons.
Les ions
On comprend donc comment des atomes se lient pour donner des molécules. L'exemple du sel va nous permettre de comprendre ce qu'est un ion.
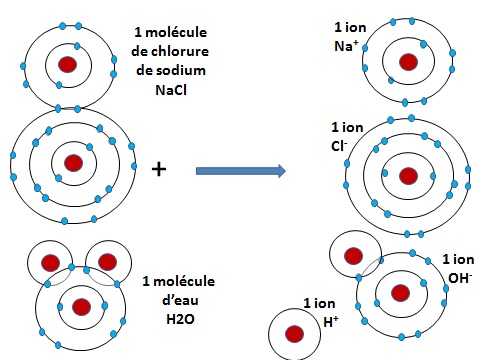 En effet, quand le sel se dissout dans l'eau, ses liens vont avoir tendance à se disloquer. On voit sur ce quatrième schéma que la molécule de sel et celle de l'eau vont se séparer en quatre éléments qui auront 8 électrons sur leur orbite périphérique. Seul celui d'hydrogène n'en n'aura plus. On l'appelle l'ion H+ avec un signe + pour montrer qu'il a plus de proton positifs (1) que d'électron négatif) (0).
En effet, quand le sel se dissout dans l'eau, ses liens vont avoir tendance à se disloquer. On voit sur ce quatrième schéma que la molécule de sel et celle de l'eau vont se séparer en quatre éléments qui auront 8 électrons sur leur orbite périphérique. Seul celui d'hydrogène n'en n'aura plus. On l'appelle l'ion H+ avec un signe + pour montrer qu'il a plus de proton positifs (1) que d'électron négatif) (0).
Le Sodium (Na+), lui aussi, est également un ion positif (appelé cation) car il a plus de proton (11) que d'électrons (10). Il lui manque l'electron de sa 3ème orbite extérieure pour revenir à sa structure stable.
Les autres ions sont négatifs (ou anions), car ils disposent de plus d'électrons que de protons. L'ion OH- a 9 protons (8 venant du noyau d'oxygène et 1 venant du noyau d'hydrogène), mais il a 10 électrons sur la 2nde orbite du noyau d'oxygène. Il en a un en excès sur pour revenir à la structure stable de l'eau (H2O).
Ce sont tous les ions qui, dans un liquide, s'attirent ou se repoussent dans un immense mouvement. C'est la présence ou non de beaucoup d'ions hydrogènes H+ qui va lui donner son acidité.
C'est quoi la photosynthèse ?
 La photosynthèse est un processus biologique qui permet aux plantes, aux algues et à certaines bactéries de synthétiser de la matière organique. Grâce à la lumière du soleil, elles peuvent produire en particulier des sortes de sucres qu'on appelle des oses tels que le glucose. Ils sont synthétisés à partir du dioxyde de carbone CO2 de l'air et de l'eau H2O qui vient à la fois des racines et de la vapeur d'eau de l'air.
La photosynthèse est un processus biologique qui permet aux plantes, aux algues et à certaines bactéries de synthétiser de la matière organique. Grâce à la lumière du soleil, elles peuvent produire en particulier des sortes de sucres qu'on appelle des oses tels que le glucose. Ils sont synthétisés à partir du dioxyde de carbone CO2 de l'air et de l'eau H2O qui vient à la fois des racines et de la vapeur d'eau de l'air.
- Pendant la journée, une plante respire et fait de la photosynthèse grâce à la lumière.
- Pendant la nuit, la même plante ne fera que respirer et ne pourra plus faire de la photosynthèse.
En chimie, ces mécanismes se résument avec les formules suivantes:
- Pendant la journée, la plante produit du glucose:
6 H2O + 6CO2 + lumière → C6H12O6 (glucose) + 6O2
- Pendant toute la journée, y compris la nuit, elle en consomme une partie:
6O2 + C6H12O6 (glucose)→ 6CO2 + 6 H2O:
Heureusement, la plante consomme moins de glucose quand elle respire la nuit qu'elle n'en produit pendant la journée. Cela lui permet de stocker de la matière organique à base de carbone et de grandir.
Atome
Du grec Atomos qui signifie "non coupé". C'est, en chimie, une partie élémentaire de la matière.
Electron
C'est un mot moderne composé du mot anglais electric (« électrique ») et du mot grec ión (« allant »), parce qu’un ion soumis à un champ électrique se déplace. Un électron est donc un élément de matière très petit qui a des potentialités électriques.
Orbite
Du latin orbita qui signifiait "cours des astres". Cette traduction explique bien qu'il s'agit de la trajectoire circulaire poursuivie par une masse tournant autour d'une autre.
Molécule
Le mot vient du latin "moles" qui signifie "masse". Le mot molecula était un diminutif scientifique "molecula" pour parler de petites masses. En chimie, une molécule est un assemblage d'atomes plus ou moins important.
Radical
Le mot vient du latin radicalis, dérivé de radix (« racine »). Il a beaucoup de sens. Par exemple le mot peut qualifier quelque chose de "profond" ou d'important. En chimie, un radical, est un ensemble d'atomes communs à plusieurs produits qui ont des propriétés qu'elle donne à toute les familles de produits qui sont composés de ce radical.