 Les nos 40, 42 et 43 d’Actuailes, ont expliqué que l’ONU a adopté des "Objectifs de développement durable" (ODD) pour les années 2015-2030 évoquant des "limites planétaires », et la nécessité de "stabiliser la population mondiale d’ici le mi-siècle". Continuons à réfléchir avec ce "trou d’ozone" qui aurait atteint un record à cause de températures très froides. C’est ce qu’annonce, en novembre 2015, l’Organisation Météorologique Mondiale. De quoi s’agit-il ? Le protocole de Montréal, en 1989, a prétendu que son origine était humaine. Y aurait-il des limites à ne pas dépasser ?
Les nos 40, 42 et 43 d’Actuailes, ont expliqué que l’ONU a adopté des "Objectifs de développement durable" (ODD) pour les années 2015-2030 évoquant des "limites planétaires », et la nécessité de "stabiliser la population mondiale d’ici le mi-siècle". Continuons à réfléchir avec ce "trou d’ozone" qui aurait atteint un record à cause de températures très froides. C’est ce qu’annonce, en novembre 2015, l’Organisation Météorologique Mondiale. De quoi s’agit-il ? Le protocole de Montréal, en 1989, a prétendu que son origine était humaine. Y aurait-il des limites à ne pas dépasser ?
Analyse publiée dans « Actuailes n°42 »
De quoi s'agit-il ?
Qu’est-ce que le "trou d’Ozone" ?
L'ozone est un gaz formé de 3 atomes d'oxygène (O3), moins stable que l’oxygène (O2). Il est présent en altitude (13 à 40 km de haut) et nous protège en captant 97 % des rayons ultraviolets du soleil. En basse altitude, c’est aussi un polluant irritant les poumons des animaux et brûlant les végétaux les plus sensibles.
Un "trou d’ozone" est une région où l’ozone diminue, principalement au pôle sud. Mais, en 2011, il a aussi été observée au pôle nord. Pourquoi cette diminution ?
L’origine du "trou d’ozone"
a) Le "trou d’ozone": une cause humaine ?
On parle beaucoup des composés à base de chlore (on les appelle des CFC - Chloro-Fluoro-Carbones). Ces CFC sont surtout utilisés comme gaz réfrigérant dans la "production du froid" (réfrigérateurs, climatisation, canons à neige, etc...).
Or, un scientifique, Mario Molina, en 1973, a émis des hypothèses sur la baisse de l’ozone. Il ne voyait que des causes humaines. Les 5 premières hypothèses étaient: la vapeur d’eau des transports supersoniques et en particulier du "Concorde"(!), les émissions d’oxydes d'azote, les essais nucléaires atmosphériques, les engrais, et les gaz de méthane provenant des vaches et des rizières. La sixième, très en vogue, était celle du chlore s’échappant de la navette spatiale. Le rôle des CFC n’arrivait qu’en 7ème hypothèse.
Malgré tout, Mario Molina a obtenu, en 1995, un Prix Nobel de chimie sur le rôle des CFC dégradant l’ozone en oxygène simple. Mais, depuis, il a encore changé d’avis et reconnait que ses modèles étaient fondés sur des bases fragiles et incomplètes. En effet, la séquence des réactions chimiques invoquées n'a jamais été observée en laboratoire.
b) Le Protocole de Montréal
Il a été signé en 1987 pour réduire ces CFC. De même que la COP21 s’occupe du climat, le trou d’ozone est suivi par des MOP "Meeting Of the Parties". Une MOP27 se réunira au Rwanda en octobre 2016 !
Ces MOP ont prévu de remplacer les CFC par des HCHC (Hydro-Chloro-Fluoro-Carbones), puis par des Hydro-Fluorocarbones (HFC). Ces produits, aux noms bizarres, sont réputés efficaces, mais auraient un impact sur le climat. On a envisagé l’ammoniac, mais c’est un explosif dangereux. En Chine, en 2013, on a connu 135 dans trois accidents sur des installations frigorifiques à l’ammoniac.
En réalité, quand le protocole de Montréal a été signé, on connaissait mal le phénomène. Il était pourtant observé depuis 1929, c’est à dire 30 ans avant la production intensive des CFC. Comment affirmer qu’ils soient la cause du phénomène ?
c) Le "trou d’ozone": des fluctuations naturelles ?
Il y a des fluctuations saisonnières : le "trou d'ozone" est maximum au printemps, pendant la nuit polaire. Il se réduit l'été. Mais, il y a aussi des cycles pluriannuels. Pour certains, le trou "record" est en corrélation avec les rayons cosmiques. L’ozone serait au cœur d’un équilibre dynamique de chocs de particules cosmiques qui, continuellement, créent et détruisent de l’ozone (pour en savoir plus, cliquer ICI)...
On reconnait aussi que les CFC ne s’accumulent pas : une grande partie des CFC est séquestrée par la végétation puis détruite par des bactéries qui s’en nourrissent.
Enfin, il est admis qu’un autre composé (le bromure de méthyle) aurait un impact plus fort que les CFC sur l'ozone. Or, l'océan en produit beaucoup.
Conclusion
Les CFC ne représentent que 2 % du chlore émis par les volcans. Il existe au niveau planétaire, un cycle du chlore avec de multiples boucles de réactions internes à l'origine de corrections de toutes sortes de déséquilibres planétaires. La planète est une monumentale source de vie.
Comme souvent, face à des excès de règles, pas toujours fondées, on voit apparaître la contrebande : dans eaucoup de pays, il existe un marché noir des CFC.
Tout cela devrait être remis à plat, mais des industriels ont déposé des brevets de production de nouveaux produits et ne sont pas prêts à revenir en arrière.
Avec le "trou d’ozone", les mêmes questions se posent que sur le climat, les engrais, ou les particules fines : les "neuf dimensions critiques" dont parle l’ONU sont-elles des limites fondées scientifiquement ? ou bien ces "limites planétaires" sont-elles un prétexte à justifier une "stabilisation de la population mondiale" par des moyens peu moraux ?
Pour aller plus loin...
a) Comment les CFC peuvent-ils détruire l'ozone?
Les tenants de l’origine humaine de la destruction de l’ozone mettent en avant les composés chlorés ou bromés. Ils agiraient par l’intermédiaire d’une succession de deux réactions chimiques :
Cl- + O3 → ClO- + O2
puis,
ClO- + O- → Cl- + O2.
C’est le 11 octobre 1995 que le Prix Nobel de chimie a été remis à Paul Crutzen, Mario Molina et Sherwood Rowland pour "their work in atmospheric chemistry, particularly concerning the formation and décomposition of ozone". Paul Crutzen et Mario Molina sont, tous deux, membres de l’Académie pontificale des sciences. Le monde entier, à l'exception d'une petite équipe de personnes bien au courant du problème, supposa qu'un pas décisif venait d'être franchi dans l'amélioration des connaissances sous l'influence de ces trois chercheurs du Max Planck Institute, du MIT et de l'Université de Californie à Irvine. Mais, le modèle standard du trou de l'ozone lequel est actuellement très sérieusement remis en question.
b) Un prix Nobel est-il une garantie de vérité scientifique?
Autant le prix Nobel de la Paix est un événement essentiellement politique, autant les prix Nobel scientifique sont généralement sérieux. Malgré tout, il existe des cas célèbres d'erreurs:
- En 1938, c'est le chercheur italien Enrico Fermi qui reçoit le prix de chimie. Fermi avait cru produire deux nouveaux éléments chimiques auxquels il a donné le nom d’ausénium et d’hespérium. Malheureusement, ils n'existaient pas dans l'expérience du savant. Fermi s'était trompé dans son interprétation et il avait néanmoins eu le prix Nobel pour la découverte de deux éléments imaginaires...
- En 1926, Johannes Fibiger remporte le Nobel de médecine pour sa découverte du « carcinome spiroptère ». Le monde entier applaudit : le cancer est vaincu, le petit ver parasite qui le cause était démasqué ! hélas, au cours des décennies suivantes, on va comprendre progressivement que le suspect n’est pas cancérigène. Fibiger avait effectué des contrôles insuffisants à l’aide de technologies inadéquates.
c) Comment les rayons cosmiques peuvent-ils expliquer le trou d'ozone?
Il y a des fluctuations saisonnières : le "trou de la couche d'ozone". Il se forme pendant la nuit polaire pour être maximum en début de printemps, et se réduit durant l'été...
Mais, il y a également des cycles annuels et pluriannuels dans le niveau des couches d’ozone polaires. Il serait évidemment utile d'avoir des relevés plus longs, mais il ne semble pas que les données soient disponibles bien loin en arrière pour l'ozone.
- Le professeur de McGill Michel Bourqui, spécialiste de la chimie atmosphérique précise que le trou "record" détecté au dessus du pôle Nord est attribuable en très grande partie à des fluctuations naturelles.
- Le Professeur Canadien Qin-Bin Lu, professeur de physique et d'astronomie à l'Université de Waterloo, pense également que le trou de l'ozone doit tout ou presque, aux rayons cosmiques. Dans une étude parue dans la revue "Physical Review letters" du 20.3.2009, il montre la corrélation entre les rayons cosmiques et la déperdition d’ozone.
d) Qu'appelle-t-on la "nuit polaire"?
La nuit polaire est une période de l'année durant laquelle le Soleil ne se lève pas. Ce phénomène est observable dans les régions polaires au-delà des cercles polaires Arctique et Antarctique. Cette "nuit polaire" ne dure qu'une seule journée au niveau du cercle polaire, mais elle dure six mois au pôle. La durée est donc d'environ trois mois aux distances intermédiaires. Ce sont des périodes encore plus froides que les autres.
e) La nature contient-elle du chlore ?
Le chlore participe à un cycle complexe au sein des écosystèmes. Il est présent sous deux formes dans la nature:
Sous forme solide
- Le chlore minéral, sous forme de chlorures, dans les eaux, principalement dans les eaux de mer, ou dans certaines roches (25 à 210 mg de chlore par kg de roche). Ils sont considérés inertes du fait de leur faible réactivité.
- Le chlore organique qui existe en quantités non négligeables soit dans l'humus des sols (34 à 689 mg de chlore par kg de sol), soit dans les arômes de toutes sortes de plantes (0.1 et 104 mg de chlore/m2 de couvert végétal).
Le chlore change de nature par deux processus inverses:
- La "chloruration" de la matière organique. Ce phénomène est provoqué par les microorganismes et certains végétaux, le plus souvent des bactéries et des champignons qui, par leur activité, convertissent les chlorures en chlore. Le chlore ainsi formé réagit instantanément avec tout composé organique : c’est ainsi que se forment les composés organo-chlorés naturels. D'autres mécanismes de formation de molécules organo-chlorées sont liées à des oxido-réductions reliées au cycle du fer.
- La déchloruration naturelle de la matière organique se fait le plus souvent simplement par minéralisation du chlore organique ou également par des bactéries Dehalococcoides, soit par des procédés biotiques.Il faudrait des températures très basses, pour que les composés chlorés se convertissent en des molécules de chlore moléculaire Cl2. Cette conversion se fait à la surface de nuages de glace stratosphériques.
La dynamique du chlore dans la nature est régulée via des processus naturels essentiellement issus de l’activité microbienne du sol. L'homme utilise le chlore minéralisé sous forme de sel de sodium et lui fait subir une électrolyse pour pour produire du chlore sous forme gazeuse. Mais le chlore gazeux existe également à l'état naturel:
Sous forme gazeuse
Le chlore est un gaz jaune-vert qui a une odeur suffocante très désagréable et est extrêmement toxique. Dans l'atmosphère, ce sont les ressources naturelles qui dégagent le plus de chlore par an :
. 5,00 millions de T/an par les bactéries océaniques
. 8,40 millions de T/an avec la combustion de la biomasse
36,00 millions de T par les Volcans
49,40 millions de T au total
Ce chiffre est à comparer avec les émissions de CFC qui ne sont que de 0.75 millions de T/an. La quantité de chlore libérée par la production mondiale de CFC, si elle a lieu, ne représente tout de même qu'une infime partie de la quantité de chlore globale libérée dans l'atmosphère.
L'impact des volcans est considérable:
- Le volcan de l'île de Satsuma Iwojima, au sud du Japon,déverse chaque jour dans l'atmosphère quelque 135 T de chlore, plus que des centaines d'usines.
- Le volcan du Mont Erebus au pôle Sud est en éruption permanente depuis 1972. Si le chlore avait un effet sur l'ozone, on doit considérer l'énormité de la quantité de chlore dégagé par ce volcan et le fait que ce gaz soit directement envoyé à des hauteurs vertigineuses dans l'atmosphère. On estime à 370.000 tonnes le chlore dégagé par cet unique volcan en une année.
- Le volcanologue chimiste Steffen Kutterolf a été également en mesure de déterminer que l’éruption du Haut Apoyo, au Nicaragua a relâché, il y a 24.500 ans, 120 millions de tonnes de chlore dans la stratosphère.
Pour approfondir...
Comment les rayons cosmiques peuvent agir sur la couche d'ozone?
- Les électrons
- Les quarks et antiquarks. Ceux-ci, en fonction de leurs interactions constituent des « hodrons » dénommés,
* Mesons ou Bosons quand les quarks sont en nombre pairs (on distingue les Pions, Kaons, Eta, Rho, Phi, etc..;)
* Baryons ou fermitons quand les quarks sont en nombre impairs. Parmi eux, on classe les nucléons (protons et neutrons) parce qu’ils constituent le noyau des molécules autour desquels tournent les électrons.
* par les gluons (interaction nucléaire forte)
* par les photons (interaction électromagnétique)
* par les bosons lourds (interaction nucléaire faible)
* par des gravitons encore imaginaires parce que non découverts (gravitation)
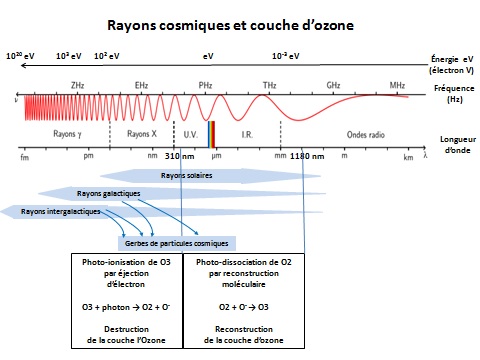 Les modèles utilisés pour décrire ces transformations sont ceux de la théorie ondulatoire.Au niveau de rayonnement de 310nm, l’ozone sera soumis à une force d’arrachement d’un électron qui le compose. C’est à partir de ce seuil appelé « énergie d’ionisation », qu’un photon d’énergie supérieure provoquera l’ionisation de l’atome par éjection d’un électron. En pratique, dès que la longueur d’onde des photons incidents sur l’ozone est supérieur à 310 nm la réaction d’ionisation suivante se déclenche:
Les modèles utilisés pour décrire ces transformations sont ceux de la théorie ondulatoire.Au niveau de rayonnement de 310nm, l’ozone sera soumis à une force d’arrachement d’un électron qui le compose. C’est à partir de ce seuil appelé « énergie d’ionisation », qu’un photon d’énergie supérieure provoquera l’ionisation de l’atome par éjection d’un électron. En pratique, dès que la longueur d’onde des photons incidents sur l’ozone est supérieur à 310 nm la réaction d’ionisation suivante se déclenche:
En pratique, dès que la longueur d’onde des photons incidents sur l’ozone est inférieure à 1180 nm la réaction de dissociation suivante se déclenche:
Plus l'activité solaire est grande, plus le magnétisme solaire dévie les rayons venant du reste du cosmos. C'est ce qui expliquerait que la couche d'ozone se reconstitue quand l'activité solaire ralentit et inversement.
Il se trouve que le soleil émet surtout des UV courts. Quant aux rayons galactiques ou intergalactiques, leur énergie est d’autant plus considérable que leur origine est éloignée. Les particules de rayons X ou de rayons gamma sont dissociés à leur contact avec l’atmosphère et transformés en mésons, en pions, ou en photons d’énergie inférieure, plus proche de celle des rayons UV longs. On parle d'une "gerbe de particules". Cette quantité considérable de rayons UV longs pourraient alors expliquer les cycles de destruction de la couche d’ozone. Lorsque l’activité solaire est importante, les effets magnétiques dévient une proportion importante de rayons galactiques, tout en émettant plus de rayons UV courts. Cette double conjonction favoriserait le déplacement de l’équilibre O2 ↔ O3 pour reconstituer la couche d’ozone.
Pour expliquer ce lien possible entre les rayons cosmiques et la destruction de la couche d’ozone, il faut commencer par essayer de vulgariser la science cosmique.
La matière cosmique
La matière garde encore de nombreux mystères quant à sa constitution. Les connaissances actuelles distinguent des particules élémentaires :
On modélise les interactions de ces particules en disant que leur énergie est transportée:
Ces quatre concepts sont donc des "quantum d'énergie" associés aux ondes électromagnétiques (allant des ondes radio aux rayons gamma en passant par la lumière visible), qui présentent certaines caractéristiques de particule élémentaire, sans en être vraiment puisque leur masse est nulle.
Le rayonnement cosmique
Toutes ces particules traversent le cosmos en tout sens à la suite d’explosions de supernovas ou plus simplement d’éruptions solaires. On modélise ces rayonnements en essayant d’observer leurs transformations en fonction des obstacles rencontrés ou des perturbations électromagnétiques qu’elles subissent. Ces transformations s’accompagnent de transferts d’énergie.
L’énergie E d’une particule dépend de sa fréquence v liées par la constante de Planck : E = 6,6x10-34 x v
L’effet des rayons cosmiques sur l’ozone
L’ozone, comme chaque gaz de l’atmosphère peut faire l’objet de chocs de particules. Sous ces effets, deux mécanismes peuvent entrer en jeu:
* la photo-ionisation : Un atome peut voir son niveau d’énergie augmenter lors d’un choc avec un photon. Pour cela, il faut que le photon ait un niveau d’énergie qui le permette. C’est sa longueur d’onde qui va en décider. Si l’atome est soumis à un rayonnement de longueur d’onde inadaptée, l’atome n’interagira pas avec les photons. L’atome sera transparent au reste du rayonnement.
O3 + photon → O2 + O.
Ce mécanisme pourrait expliquer la destruction des "couches d’ozone". Plus l’activité cosmique serait importante, plus elles se détruiraient.
* la photodissociation : Si l’énergie du photon incident est supérieure ou égale à l’énergie des liaisons au sein de la molécule, alors on peut observer la rupture d’une liaison. Dans le cas de l’oxygène, l’énergie requise pour la dissociation d’une liaison covalente entre deux atomes est de l’ordre de 100 kJ.mol-1, ce qui correspond à un rayonnement de longueur d’onde 1180 nm qui se situe dans l’infrarouge qui sont émis essentiellement par le soleil.
O2 + O → O3.
Ce mécanisme pourrait expliquer la reconstitution des "couches d’ozone". Plus l’activité solaire serait importante, plus elles se reconstitueraient.
* Le rôle inhibiteur de l'activité solaire sur les rayons cosmiques.
Comment l'ozone absorbe-t-il les rayons UV?
C’est la photodissociation qui est responsable de l’absorption d’une partie des UV-A.
Ainsi, l’ozone serait donc au cœur d’un équilibre dynamique au sein duquel il est continuellement créé et détruit. C’est ce qu’on appelle le cycle de Chapman : La production de l’ozone dans l’atmosphère est assurée par la photodissociation du dioxygène O2 sous l’effet des UV courts. L’ozone peut être dissocié par des UV plus longs (l<310nm) que ceux qui provoquent la dissociation de l'O2.
Le rôle d’atomes catalyseur ?
La théorie anthropique de la couche d’ozone voudrait que le chlore joue un rôle de catalyseur dans ces mécanismes.
Les scientifiques qui ont apporté leur soutien au rôle du Chlore –comme Paul Crutzen, avant qu’il ne change, semble-t-il, d’avis– ont développé des modèles mathématiques complexes qui démontraient - nous disait-on - que les CFC rejetés par l’homme détruisaient inexorablement la couche d’ozone. Mais ces modèles étaient en réalité fondés sur des bases expérimentales extrêmement fragiles et incomplètes. En effet, la séquence des réactions chimiques invoquées n'a jamais été observée en laboratoire : Cl- + O3 + O- → Cl- + 2O2.
Atome
Du grec Atomos qui signifie "non coupé". C'est, en chimie, une partie élémentaire de la matière
Ultraviolet
Le nom signifie au-delà du violet (du latin ultra: « au-delà de »), le violet étant la couleur de fréquence la plus élevée de la lumière visible. Dans un arc en ciel, on ne voit pas l'ultraviolet.
Composé chimique
Du latin componere qui signifie "placé ensemble". Un composé chimique est formé par la réunion de produits chimiques divers. Les CFC sont des composés àpartir de chlore, de fluor et de carbone
Oxyde
Du grec ancien oxús (« aigu, piquant »). Un oxyde désigne des sels contenant de l'oxygène qui les rendent piquants au goût.
Prix Nobel
Le savant Alfred Nobel a laissé une partie de sa fortune à une fondation destinée à récompenser des personnes ayant apporté à l'humanité des inventions ou découvertes. Le prix Nobel de la Paix est norvégien et choisi par un comité désigné par le parlement d’Oslo, alors que les autres prix Nobel sont suédois et que les bénéficiaires sont choisis par des pairs de leurs sciences respectives.
Corrélation
Vient du latin correlatio "relation mutuelle". En sciences, ont dit que des réalités sont corrélées quand elles évoluent ensemble. C'est un "faux ami", car cela ne signifie pas toujours qu'il y a, entre elles, une relation de cause à effet. Par exemple les gens habitant près de pylônes à haute tension sont plus souvent malades que les autres. Le courant électrique en est-il la cause ? Non, car les habitants sous les pylônes sont souvent plus pauvres, et on sait les liens santé-pauvreté