 Une étude publiée en novembre 2015 par Patrick More[1], président du programme Énergie, écologie et prospérité du Centre Exploratoire pour les Politiques Publiques, explique que le terme «acidification des océans» est en soi plutôt trompeur. L'échelle de pH varie de 0 à 14, dans laquelle 7 est neutre, inférieur à 7 est acide et au-dessus de 7 est basique ou alcalin. Le pH des océans du monde varie de 7,5 à 8,3, entièrement dans l'échelle alcaline. Le Dr More est un transfuge de Greenpeace après avoir participé à sa fondation.
Une étude publiée en novembre 2015 par Patrick More[1], président du programme Énergie, écologie et prospérité du Centre Exploratoire pour les Politiques Publiques, explique que le terme «acidification des océans» est en soi plutôt trompeur. L'échelle de pH varie de 0 à 14, dans laquelle 7 est neutre, inférieur à 7 est acide et au-dessus de 7 est basique ou alcalin. Le pH des océans du monde varie de 7,5 à 8,3, entièrement dans l'échelle alcaline. Le Dr More est un transfuge de Greenpeace après avoir participé à sa fondation.
Son étude, revue par des pairs anonymes, se résume en 10 points :
- Le concept d'acidification des océans est un phénomène récent qui a entraîné une explosion d'articles de journaux, de rapports médiatiques et de publications alarmistes d'organisations environnementales
- De nombreux documents sur l'acidification des océans, dits être causés par la hausse des niveaux anthropiques de CO2 dans l'atmosphère, prédisent que cela aboutira à l'extinction massive des espèces marines qui utilisent la calcification, y compris les coraux, les crustacés et de nombreuses espèces de plancton, et que cela, à son tour, entraînera l'extinction de nombreuses autres espèces marines.
- Les hypothèses sur le pH de l'océan pré-industriel commençant vers 1750 et les études de laboratoire ne peuvent pas reproduire de manière adéquate les conditions océaniques naturelles qui sont à la base des prédictions du futur pH des océans.
- Les espèces marines calcifiantes ont survécu pendant des millions d'années au cours desquelles le CO2 était à des niveaux beaucoup plus élevés dans l'atmosphère.
- Toutes les espèces sont capables de s'adapter aux changements dans leurs environnements. Sur le long terme, l'évolution génétique a permis à toutes les espèces existantes aujourd'hui, et à leurs ancêtres, de survivre à des changements radicaux au cours des millénaires. À court terme, la plasticité phénotypique et la plasticité transgénérationnelle permettent aux espèces de s'adapter aux changements environnementaux de manière relativement rapide.
- L'eau de mer a une très grande capacité de tampon qui empêche de grands changements de pH lorsque des acides faibles, tels que l'acide carbonique, ou des bases faibles y sont ajoutés.
- Toutes les espèces, y compris les espèces marines calcifiantes, sont capables de contrôler leur chimie interne dans un large éventail de conditions extérieures.
- Si les prévisions de réchauffement climatique continuent, les océans deviennent plus chauds et auront tendance à dégager le CO2, compensant dans une certaine mesure la petite pression partielle accrue qui pourrait se produire autrement.
- Une analyse de la recherche sur l'effet d'un pH plus acide montre un impact net bénéfique sur la calcification, le métabolisme, la croissance, la fertilité et la survie des espèces marines calcifiantes lorsque le pH est abaissé jusqu'à 0,3 unité, ce qui dépasse ce qui est considéré comme une réduction plausible pendant ce siècle.
- Il n'existe aucune preuve à l'appui de l'affirmation selon laquelle les espèces marines les plus calcifiantes disparaîtront en raison des niveaux plus élevés de CO2 dans l'atmosphère et d'un pH plus faible dans les océans.
Quel est le contenu de cette étude ?
Source : Frontier Centre for Public Policy
Transcription : « les2ailes.com »
Les2ailes.com donnent ici une traduction intégrale de l’étude[2] en question menées par le Centre Exploratoire pour les Politiques Publiques[3] :
1- RÉSUMÉ POUR DÉCIDEURS
Il s’agit des dix points repris dans l’introduction ci-dessus.
2- INTRODUCTION
Bien qu'il y ait quelques références antérieures dans la littérature, ce n'est qu'en 2003 qu'une explosion d'articles de journaux, de rapports médiatiques et de publications brillantes de groupes environnementaux sur le sujet de l'acidification des océans a commencé à apparaître. Cela a coïncidé avec un article publié dans la revue Nature, qui a signalé que les émissions humaines de dioxyde de carbone (CO2) "pourraient entraîner des changements de pH plus importants [dans les océans] au cours des prochains siècles que ceux déduits du bilan géologique des 300 derniers millions d'années "[4].
L'hypothèse d'acidification des océans suppose que l'augmentation des niveaux atmosphériques de CO2 entraînera inévitablement que les océans deviennent plus acides puisqu'ils absorbent plus de CO2, dont une partie réagit dans la mer pour devenir de l'acide carbonique. À son tour, une baisse du pH devrait entraîner un impact grave, même "catastrophique", sur les coquillages, le plancton et les coraux, espèces qui construisent des coques de protection du carbonate de calcium à partir du calcium et du CO2 dissous dans l'eau de mer. La baisse projetée du pH de l'océan va alors rendre difficile ou même impossible pour ces espèces de construire leurs coquillages, et ainsi, certaines personnes ont déclaré qu'elles allaient s'éteindre.
Le terme «acidification des océans» est en soi plutôt trompeur. L'échelle de pH varie de 0 à 14, dans laquelle 7 est neutre, inférieur à 7 est acide et au-dessus de 7 est basique ou alcalin. Le pH des océans du monde varie de 7,5 à 8,3, tout à fait dans l'échelle alcaline. Il est donc incorrect d'affirmer que les océans sont acides et aucun scénario convenable ne permet de dire qu'ils deviendront acides. Le terme «acidification» est utilisé pour impliquer que les océans deviennent effectivement acides. Il es’agitst peut-être simplement d’une manière d’utiliser la langue en vue d’une propagande, car il est bien connu que les termes «acide» et «acidifié» ont de fortes connotations négatives pour la plupart des gens.
Il y aurait certainement une conséquence désastreuse si les émissions humaines de CO2 éliminaient toutes les palourdes, les huîtres, les escargots, les crabes, les crevettes, les homards, les récifs coralliens et les nombreuses autres espèces calcaires dans les océans. Cet article examinera cette hypothèse en détail et évaluera ses hypothèses contraires aux observations du monde réel et aux connaissances scientifiques.
Il est bien documenté que, de 1996 à 2014, il n'y a plus eu de réchauffement statistiquement significatif du climat mondial[5]. Il y a quelques années, le terme «réchauffement climatique» a été largement supplanté par le terme «changement climatique» en raison de l'affirmation delon laquelle le réchauffement aurait frappé - avec des effets tels que les changements dans les précipitations, etc. Cependant, s'il n'y a plus de réchauffement récent, il s'ensuit qu'il n'y a pas eu de changement significatif dans le climat pendant cette période. Le fait qu'environ 30 pour cent de toutes les émissions de CO2 humaines depuis le début de l'ère industrielle s'est produite au cours de ce «hiatus» ou «pause» a conduit à remettre en question la certitude indiquée que l'augmentation du CO2 atmosphérique conduira inévitablement à un réchauffement significatif de la planète. Cela remet en question la logique consistant à dépenser des milliards de dollars sur un «problème» qui peut être sans conséquence ou peut-être même inexistant.
Pour ceux qui font campagne sur la question du changement climatique, le spectre de l'acidification des océans résout parfaitement le problème créé par la récente pause du réchauffement. L'hypothèse de l'acidification des océans ne nécessite pas de réchauffement, de changement de climat ou d'augmentation des phénomènes météorologiques extrêmes. Sa seule base est l'affirmation selon laquelle des niveaux plus élevés de CO2 dans l'atmosphère entraîneront une baisse du pH de l'océan, ce qui entraînera l'extinction des mollusques et autres espèces marines calcifiantes. L'acidification de l'océan a été baptisée "le jumeau maléfique du réchauffement climatique", ce qui a entraîné une certaine morale de culpabilité dans la discussion[6].
Même les scientifiques utilisent une langue alarmiste alors qu’on pourrait s’attendre à ce que leur ton soit plus modéré. Un exemple du journal Trends in Ecology and Evolution:
L'augmentation anthropique du CO2 atmosphérique entraîne des changements fondamentaux et sans précédent dans la chimie des océans. ... Nous soutenons que les conditions océaniques sont déjà plus extrêmes que celles des organismes marins et des écosystèmes depuis des millions d'années, soulignant la nécessité urgente d'adopter des politiques qui réduisent drastiquement les émissions de CO2 [7].
Pourtant, dans le même article, on lit que «la compréhension des implications de ces changements dans la chimie de l'eau de mer pour les organismes marins et les écosystèmes en est à ses débuts» [8].
En 2009, le Conseil de Défense des Ressources Naturelles (NRDC)[9], un groupe de défense de l'environnement, disait que "au milieu du siècle ... les récifs coralliens cesseront de croître et même commencent à se dissoudre" et l'acidification des océans "aura une incidence sur les pêcheries commerciales dans le monde, menaçant une source de nourriture pour des centaines de millions de personnes ainsi que pour une industrie de plusieurs milliards de dollars "[10]. Par conséquent, non seulement les espèces calcifiées sont menacées, mais aussi le maillage entier de la vie dans les mers.
Le document du NRDC a également soutenu: «L'acidification peut déjà avoir une incidence sur la vie marine autour du monde. Par exemple, les huîtres du Pacifique ne se sont pas reproduites avec succès depuis 2004 ». Cette affirmation est très trompeuse, la production d'huîtres du Pacifique, ayant progressivement augmenté de 150 000 tonnes en 1950 à plus de 500 000 tonnes en 2013, est basée sur la collecte de graines sauvages (naissain) .[11]
Les promoteurs de l'acidification des océans pensent que les océans absorbent 30 à 50 pour cent des émissions de CO2 humaines.[12] Une étude de 30 ans près des Bermudes donne des preuves que les océans absorbent le CO2 de l'atmosphère[13]. Une autre étude fondée sur l'observation directe des données en question dans la région a indiqué que, de plus en plus, le CO2 qui ne se développait pas dans l'atmosphère était absorbé par la biomasse sur la terre.
Les tendances croissantes de l'absorption de carbone au cours de la période 1995-2008 sont presque unanimement placées dans la biosphère terrestre (en supposant que les tendances des combustibles fossiles soient correctes), avec une petite augmentation de l'océan seulement présente dans quelques inversions. Le cycle de CO2 atmosphérique n'est probablement pas assez dense pour confirmer ou invalider l'augmentation de la consommation mondiale de carbone océanique, estimée à partir de mesures océaniques ou de modèles océaniques. »[14]
Il existe une preuve directe que les arbres et les plantes prennent un pourcentage des émissions anthropiques de CO2 à mesure que les niveaux de CO2 augmentent[15]. L'effet de fertilisation par le CO2 est bien documenté. Les producteurs de serres à travers le monde augmentent volontairement le niveau de CO2 dans leurs serres afin d'augmenter le rendement de leurs récoltes jusqu'à concurrence de 50%. Il ne fait aucun doute que les plantes terrestres bénéficient en grande partie des niveaux accrus de CO2 dans l'air. Alors que le CO2 est maintenant d'environ 400 ppm, la croissance optimale de la plupart des plantes se situe entre 1 500 et 2 000 ppm, et dans certaines espèces, elle est beaucoup plus élevée. La distinction exacte entre le CO2 absorbé par les océans et le CO2 contribuant à l'augmentation de la biomasse terrestre est très difficile à déterminer.
Cet article considérera cinq facteurs qui remettent en question l'affirmation selon laquelle l'acidification des océans est une crise qui menace l'ensemble des espèces calcifiant, ainsi que l’extinction de nombreuses autres espèces. Il est important de reconnaître le rôle joué par le langage apocalyptique dans cette discussion. On peut dire avec justesse: «L'émission humaine de CO2 entraînera une légère réduction du pH de l'océan qui se situe bien dans les niveaux historiques pendant lesquels les espèces calcifiantes ont survécu et ont même prospéré». Ou, on pourrait dire: «Le réchauffement climatique et l'acidification des océans entraînera la mort de tous les récifs coralliens d'ici 2050, entraînant l'extinction de milliers d'espèces alors que l'environnement marin est poussé au bord de l'effondrement écologique ». Cette dernière déclaration est beaucoup plus susceptible d'être imprimée dans les journaux et d’être diffusée autour du monde.[16] Ce n'est pas une science objective mais plutôt une prédiction alarmiste qui a peu de base dans les faits ni en logique. Il est nécessaire de lancer ici un appel à la pensée critique dans la population afin de distinguer entre le factuel et le prédictif et entre la langue sobre et les prédictions apocalyptiques.
3- L'ENREGISTREMENT HISTORIQUE DU CO2 ET DE LA TEMPÉRATURE DANS L'ATMOSPHÈRE
Tout le CO2 dans l'atmosphère est venu de l'intérieur de la Terre. Au début de la vie de la planète, la Terre était beaucoup plus chaude, et il y avait beaucoup plus d'activité volcanique qu'aujourd'hui. La chaleur du noyau a amené le carbone et l'oxygène à se combiner pour former du CO2, ce qui est devenu une partie importante de l'atmosphère initial de la Terre, peut-être la composante la plus abondante jusqu'à ce que la photosynthèse ait évolué. La plupart des émissions de CO2 dans les océans proviennent de l'atmosphère, même si certaines sont injectées directement à partir des évents océaniques.
Il est largement admis que la concentration de CO2 était plus élevée dans l'atmosphère de la Terre avant que les formes de vie modernes ne se développent pendant la période cambrienne, qui a commencé il y a 544 millions d'années. C'est aussi à cette époque qu'un certain nombre d'espèces marines ont développé une capacité à contrôler la calcification, par exemple sous le terme plus général de «biominéralisation» .[17] Cela a permis à ces espèces de construire des coquilles dures de carbonate de calcium (CaCO3) autour de leurs corps mous , fournissant ainsi un type de blindage. Les crustacés précoces tels que les palourdes sont apparus il y a plus de 500 millions d'années, lorsque le CO2 atmosphérique était 10 à 15 fois plus élevé qu'il n'en est aujourd'hui.[18] De toute évidence, le pH des océans n'a pas provoqué l'extinction des coraux ou des crustacés sinon ils ne seraient pas ici aujourd'hui. Pourquoi, nous dit-on que, même au niveau beaucoup plus bas d'aujourd'hui, le CO2 provoque déjà des dommages sur les espèces calcifiantes?
L'argument le plus courant est le suivant: «les espèces de coraux et de coquillages d'aujourd'hui ne sont pas adaptées au niveau de CO2 que les espèces anciennes connaissaient bien. L'acidification se passe si rapidement que les espèces ne seront pas capables de s'adapter à des niveaux plus élevés de CO2». Ceci est absurde dans le fait que, du point de vue biochimique, il n'y a aucune raison de croire que ces espèces ont perdu leur capacité à calcifier aux niveaux de CO2 plus élevés qui existaient depuis des millions d'années dans le passé. Les ancêtres de toutes les espèces vivantes ont survécu pendant des millénaires au cours desquels des conditions ont parfois changé très rapidement, par exemple lorsqu'un astéroïde a causé l'extinction des dinosaures et de nombreuses autres espèces il y a 65 millions d'années. Bien que beaucoup plus d'espèces se soient éteintes qu'il n’en existe encore en vie aujourd'hui, il faut dire que les espèces qui ont traversé ces temps ont été les plus résistantes dans le temps et aux changements.
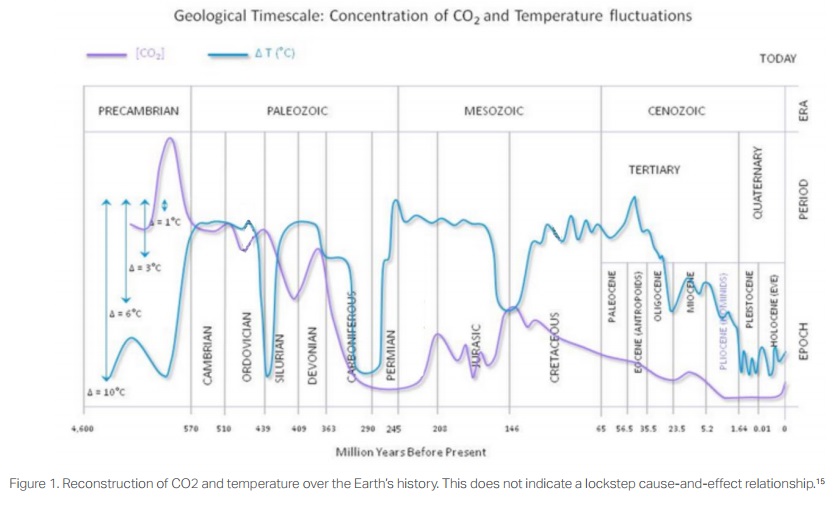 Jusqu'à présent, il n'y a eu qu'une autre période de l'histoire de la Terre lorsque le CO2 était presque aussi faible que durant les 2,5 millions d'années de l'âge de glace du Pléistocène. Au cours de la période carbonifère tardive et dans les périodes permienne et triassique, le CO2 a été réduit d'environ 4000 ppm à environ 400 ppm, probablement en raison de l'avènement de vastes zones de forêt qui ont éliminé le CO2 de l'atmosphère et l'ont incorporé dans le bois et donc transformé en charbone (voir la figure 1[19]). Nous savons, à partir des carottes de glace antarctique, que le CO2 a été réduit de 180 ppm pendant le Pleistocène, à seulement 30 ppm au-dessus du seuil pour la survie des plantes, au sommet des progrès glaciaires (voir la figure 2[20]). Ces périodes de faible émission de CO2 atmosphérique, comme c'est le cas actuellement, sont une exception par rapport aux périodes beaucoup plus longues où le CO2 était supérieur à 1000 ppm et souvent beaucoup plus élevé.
Jusqu'à présent, il n'y a eu qu'une autre période de l'histoire de la Terre lorsque le CO2 était presque aussi faible que durant les 2,5 millions d'années de l'âge de glace du Pléistocène. Au cours de la période carbonifère tardive et dans les périodes permienne et triassique, le CO2 a été réduit d'environ 4000 ppm à environ 400 ppm, probablement en raison de l'avènement de vastes zones de forêt qui ont éliminé le CO2 de l'atmosphère et l'ont incorporé dans le bois et donc transformé en charbone (voir la figure 1[19]). Nous savons, à partir des carottes de glace antarctique, que le CO2 a été réduit de 180 ppm pendant le Pleistocène, à seulement 30 ppm au-dessus du seuil pour la survie des plantes, au sommet des progrès glaciaires (voir la figure 2[20]). Ces périodes de faible émission de CO2 atmosphérique, comme c'est le cas actuellement, sont une exception par rapport aux périodes beaucoup plus longues où le CO2 était supérieur à 1000 ppm et souvent beaucoup plus élevé.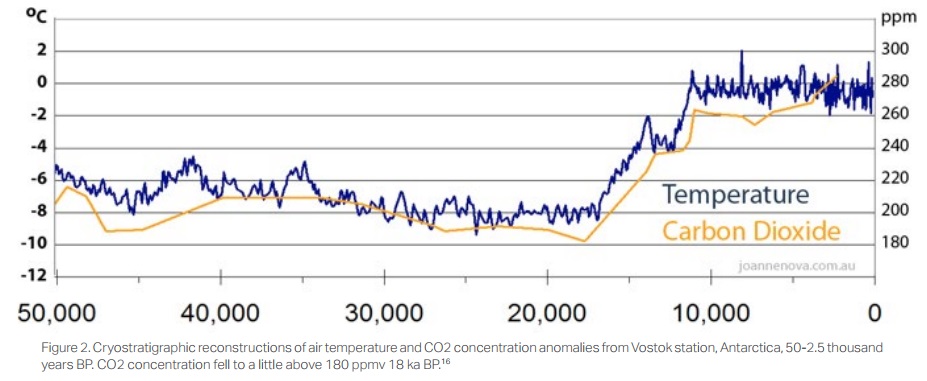
Pour cette seule raison, la possibilité que les niveaux actuels et futurs de CO2 atmosphérique causent des dommages importants à la vie marine calcifiante devraient être remis en question. Cependant, un certain nombre d'autres facteurs mettent en doute l'hypothèse d'acidification de l'océan.
4- L'ADAPTATION DES ESPÈCES AUX CONDITIONS ENVIRONNEMENTALES
Les gens ont tendance à supposer qu'il faut des milliers ou des millions d'années pour que les espèces s'adaptent aux changements dans l'environnement. Ce n'est pas le cas. Même les espèces ayant des périodes de reproduction relativement longues peuvent s'adapter relativement rapidement lorsqu'elles sont confrontées à des conditions environnementales qui changent rapidement. En fait, il change rapidement les conditions environnementales qui favorisent un changement et une adaptation évolutifs de l'évolution[21]. Stephen Jay Gould l'explique bien dans sa merveille merveilleuse classique, qui met l'accent sur l'explosion cambrienne et l'évolution d'un grand nombre d'espèces, il y a 544 millions d'années[22].
La plupart des invertébrés qui ont développé la capacité de produire une armure de carbonate de calcium sont capables d'une adaptation relativement rapide aux changements dans leur environnement en raison de deux facteurs distincts. Tout d'abord, ils se reproduisent au moins une fois par an et parfois plus fréquemment. Cela signifie que leur descendance est testée sur une base annuelle pour être adapté à un environnement changeant. Deuxièmement, ces espèces produisent des milliers ou des millions de descendants chaque fois qu'ils se reproduisent. Cela augmente considérablement la possibilité que des mutations génétiques mieux adaptées aux changements dans les conditions environnementales se produisent chez certains descendants.
Un certain nombre d'études ont démontré que le changement dans le patrimoine génétique d'un organisme ou le génotype n'est pas le seul facteur qui permet aux espèces de s'adapter aux conditions changeantes de l’environnement. De nombreuses espèces marines vivent dans les eaux côtières pendant une partie ou la totalité de leur vie où elles sont exposées à des plages de pH, de CO2, d'O2, de température et de salinité beaucoup plus larges que celles qui se manifestent en plein air. Il existe deux mécanismes physiologiques distincts permettant l'adaptation au changement environnemental beaucoup plus rapidement que par le changement du génotype par l'évolution génétique.
- La première est la plasticité phénotypique, qui est la capacité d'un génotype à produire plus d'un phénotype lorsqu'il est exposé à différents environnements[23]. En d'autres termes, un génotype spécifique peut s'exprimer différemment en raison d'une capacité à répondre de différentes manières aux variations des facteurs environnementaux. Cela aide à expliquer comment des individus d’une même espèce, avec des génotypes presque identiques, peuvent coloniser avec succès des environnements très différents. Des exemples de ceci existent chez les humains avec leur capacité à s'acclimater à différents régimes de température et à différentes altitudes. Il n'y a pas de changement dans le génotype, mais il y a des changements dans la physiologie.
- Le deuxième facteur, encore plus fascinant, est la plasticité transgénérationnelle, qui est la capacité des parents à transmettre leurs adaptations à leurs descendants[24]. Une étude récente a souligné que «les organismes côtiers contemporains connaissent déjà une large gamme de conditions de pH et de CO2, dont la plupart ne sont pas susceptibles de sont»[25]. Les auteurs ont utilisé ce qu'ils appelaient «une nouvelle approche expérimentale qui combinait un échantillonnage bi-hebdomadaire d'une population sauvage de poissons reproducteurs (la Capucete Menidia menidia de l'Atlantique) avec une exposition des progénitures à un taux de CO2 expérimental et standardisé et la simulation parallèle du pH d'un écosystème côtier ». Les parents et la progéniture ont été exposés à des concentrations de CO2 de 1200 ppm et de 2300 ppm par rapport au niveau ambiant d'aujourd'hui de 400 ppm. Les scientifiques rapportent que «au début de la saison (avril), des niveaux élevés de CO2 ont significativement ... réduit la survie du poisson de 54% (2012) et de 33% (2013) et réduit de 1 à 10 jours de croissance post-éclosion de 17% par rapport aux conditions ambiantes ». Cependant, ils ont constaté que « les descendants des parents recueillis plus tard dans la saison devenaient de plus en plus tolérants au CO2 jusqu'à ce que, à la mi-journée, la survie des descendants était également élevée à tous les niveaux de CO2 ». Cela indique qu'une espèce côtière de poisson est capable de s'adapter à des niveaux élevés de CO2 en très peu de temps. Il indique également que cette même espèce ne remarquerait même pas le taux relativement lent auquel le CO2 augmente dans l'atmosphère aujourd'hui.
Les changements qui se sont produits au climat de la Terre au cours des 300 dernières années, depuis le pic du « petit âge glaciaire » vers 1700, n’ont en aucun cas été inhabituels ou uniques dans l'histoire. Au cours des 3.000 dernières années, un clignotement à l’échelle géologique, il y a eu une succession de périodes de chaleur et de périodes de fraîcheur. Il n'y a pas d'enregistrement de l'extinction des espèces en raison des changements climatiques au cours de ces périodes.
5- LA CAPACITÉ DE TAMPONNAGE DES EAUX DE MER
Au cours des millénaires, les océans ont reçu des minéraux dissous dans l'eau de pluie de la terre. La plupart d'entre eux sont sous la forme d'ions tels que le chlorure, le sodium, le sulfate, le magnésium, le potassium et le calcium. Les évents hydrothermaux sous-marins et les volcans sous-marins contribuent également à la teneur en sels. Ces éléments ont permis de constituer environ 3,5 % dela masse d'eau de mer, ce qui donne à l'eau de mer des propriétés uniques par rapport à l'eau douce. Il est largement considéré, parmi les océanographes, que la teneur en sel de la mer a été constante pendant des centaines de millions, voire des milliards d'années, alors que la minéralisation sur le fond de l’eau équilibre les nouveaux sels entrant dans la mer[26].
La teneur en sel de l'eau de mer lui confère une puissante capacité tampon, capacité à résister à la variation du pH lorsqu'un composé acide ou basique est ajouté à l'eau. Par exemple, une micromole d'acide chlorhydrique ajoutée à un kilo d'eau distillée à pH 7,0 (neutre) fait chuter le pH à près de 6,0. Si la même quantité d'acide chlorhydrique est ajoutée à une eau de mer à pH 7, le pH obtenu est de 6,997, un changement de seulement 0,003 d'unité de pH. Ainsi, l'eau de mer a environ 330 fois la capacité tampon de l'eau douce[27]. En plus de la capacité tampon, il y a un autre facteur, le facteur Revelle, du nom de Roger Revelle, ancien directeur de l'Institut d'Océanographie Scripps [28]. Le facteur Revelle détermine que si le CO2 atmosphérique est doublé, le CO2 dissous dans l'océan n'augmentera que de 10 %[29].
Il est largement indiqué, dans la littérature, que le pH des océans était de 8,2 avant l'industrialisation (1750) [29bis] et que, en raison des émissions de CO2 humaines, il est tombé à 8.1[30]. Personne n'a mesuré le pH de l'eau de l'océan en 1750. Le concept de pH n'a été conçu qu'en 1909 et un pH-mètre précis n'était disponible qu'en 1924. L'affirmation selon laquelle le pH de l'océan était de 8,2 il y a plus de 250 ans, est une estimation plutôt qu'une mesure réelle. La mesure du pH avec précision dans une fourchette à 0,1 d'une unité de pH n'est pas une procédure simple même aujourd'hui. En outre, pour deux raisons, il n'y a pas de surveillance globale du pH des océans: d'abord, les océanographes authentiques connaissent la capacité de tamponnage de l'eau de mer, de sorte qu'ils ne s'attendent pas à ce que le solde acide-base global change et, deuxièmement, il n’y a aucun instrument automatisé disponible pour mesurer le pH.
Les prédictions futures du changement du pH de l'océan en raison du CO2 sont basées sur les mêmes hypothèses qui ont abouti à l'estimation du pH de 8.2 en 1750 lorsque nous n'avions aucune mesure du pH des océans à ce moment-là. Les modèles extrapolent simplement l'affirmation selon laquelle le pH est passé de 8,2 à 8,1 au cours des 265 dernières années, en calculant que le pH tombera de 0,3 de pH d'ici 2100.
De nombreux scientifiques ont répété l'affirmation selon laquelle le pH de l'océan a diminué de 0,1 au cours des 265 dernières années. Ils devraient être mis au défi de fournir des données d'observation à partir de 1750 qui soutiennent leur conclusion. Les observations de trois éloquents océanographes, dont Harald Sverdrup, ancien directeur du Scripps Institute of Oceanography, dans un livre qui couvre tous les aspects de la physique des océans, de la chimie et de la biologie mettent en doute l'affirmation de ces scientifiques. Le livre a été écrit avant le sujet du changement climatique et le dioxyde de carbone ne devienne politisé.
L'eau de mer est un milieu très favorable pour le développement d'organismes photosynthétiques. Il contient non seulement une quantité abondante de CO2, mais l'élimination ou l'addition de quantités considérables n'entraîne aucun changement marqué de la pression partielle du CO2 et du pH de la solution, qui sont tous deux des propriétés d'importance dans l'environnement biologique ....
Si une petite quantité d'un acide ou d'une base forte est ajoutée à de l'eau pure, il y a d'énormes changements dans le nombre d'H + et OH-ions présents, mais les changements sont faibles si l'acide ou la base est ajouté à une solution contenant un acide faible et ses sels ou une base faible et ses sels. Cette contrainte sur la variation du pH est connue sous le nom d'effet tampon, et de telles solutions sont appelées solutions tampons. Contenant des acides carboniques et boriques et leurs sels, l'eau de mer est donc une solution tampon. Considérons seulement le système de carbonate. Les sels de carbonate et de bicarbonate de bases fortes, tels qu'ils se produisent dans l'eau de mer, ont tendance à s’hydrolyser, et il y a toujours des ions H + et OH dans la solution. Si un acide est ajouté, le carbonate est converti en bicarbonate et le bicarbonate en acide carbonique, mais, comme ce dernier est un acide faible (seulement légèrement dissocié), relativement peu d'ions hydrogène supplémentaires sont libérés. De même, si une base forte est ajoutée, la quantité de carbonate augmente, mais les ions OH- formés dans l'hydrolyse du carbonate n'augmentent que légèrement. L'effet tampon est plus grand lorsque la concentration en ions hydrogène est égale à la constante de dissociation de l'acide ou de la base faible, c'est-à-dire lorsque la concentration de l'acide est égale à celle de son sel.[31]
En outre, une étude a été publiée dans laquelle le pH des océans a été reconstruit de 1908 à 1988, sur la base de la composition isotopique de bore d'un corail massif à longue durée de vie dans les Flinders Reef de la mer de corail occidentale du Pacifique sud-ouest[32]. Le rapport a conclu qu'il n'y avait pas de tendance notable vers des valeurs isotopiques plus faibles sur la période de 300 ans étudiée. Cela indique qu'il n'y a pas eu de changement dans le pH de l'océan pendant cette période sur ce site. Cette étude, dans laquelle les mesures réelles d'un proxy fiable ont été faites, est beaucoup plus crédible qu'une estimation basée sur des hypothèses qui n'ont pas été testées.
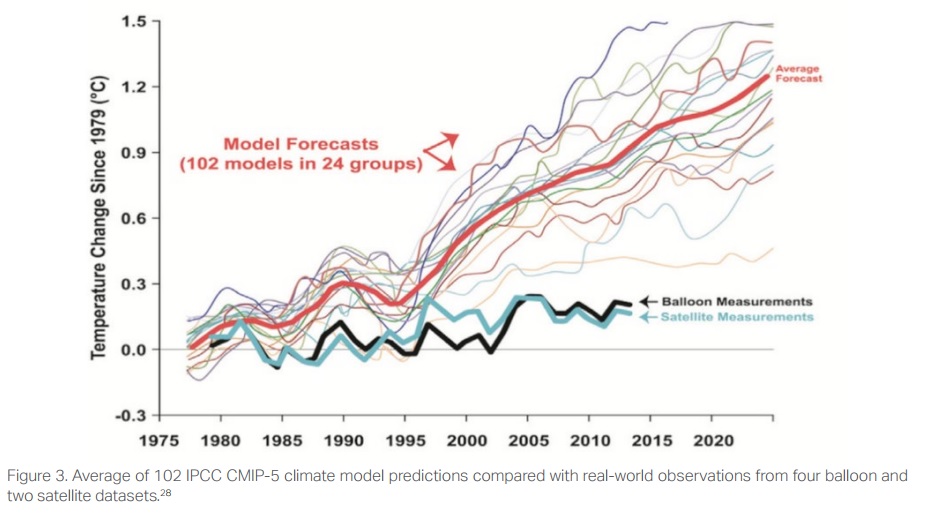 À bien des égards, les affirmations faites sur le degré de changement de pH causé par un niveau donné de CO2 atmosphérique sont analogues aux revendications sur le degré d'élévation de la température atmosphérique qui pourrait être causé par un niveau donné de CO2 atmosphérique. C'est ce qu'on appelle "sensibilité" et la littérature devient très confuse quand le sujet est recherché. Peut-être que les hypothèses utilisées pour estimer le pH futur de l'océan sont aussi discutables que celles utilisées pour estimer l'augmentation de la température due aux augmentations du CO2 atmosphérique (voir la figure 3[33]).
À bien des égards, les affirmations faites sur le degré de changement de pH causé par un niveau donné de CO2 atmosphérique sont analogues aux revendications sur le degré d'élévation de la température atmosphérique qui pourrait être causé par un niveau donné de CO2 atmosphérique. C'est ce qu'on appelle "sensibilité" et la littérature devient très confuse quand le sujet est recherché. Peut-être que les hypothèses utilisées pour estimer le pH futur de l'océan sont aussi discutables que celles utilisées pour estimer l'augmentation de la température due aux augmentations du CO2 atmosphérique (voir la figure 3[33]).
Le problème le plus grave avec l'affirmation selon laquelle le pH est passé de 8,2 à 8,1 depuis 1750 est qu'il n'y a pas de pH universel dans les océans du monde. Le pH des océans variede beaucoup plus que 0,1 sur une base quotidienne, mensuelle, annuelle et géographique. Au large des océans, le pH varie généralement de 7,5 à 8,4, ou 0,9 d'une unité de pH. Une étude au large de la Californie montre que le pH peut varier de 1,43 unité de pH sur une base mensuelle[34]. C'est près de cinq fois le changement de pH que les modèles informatiques prévoient au cours des 85 prochaines années à 2100. Dans les zones côtières qui sont influencées par s'échapper de la terre, le pH peut être aussi bas que 6,0 et jusqu'à 9,0.
 Le courant de Humboldt, une grande zone de remontée des eaux océaniques au large des côtes du Chili et du Pérou, a l'un des pH les plus bas que l'on trouve naturellement dans les océans. (Voir la figure 4[35]) Le pH de cette eau de mer est de 7,7 à 7,88[36]. Si le pH moyen de l'océan est maintenant de 8,1, l'eau dans le courant de Humboldt est déjà à un pH inférieur à celui prévu par 2100. Les remontées d’eaux ont tendance à avoir des PH plus faibles que d'autres zones de l'océan pour deux raisons. Tout d'abord, l'eau a été à une profondeur où demeurent des organismes marins qui meurent et se décomposent en éléments nutritifs, tendant à réduire le pH. Deuxièmement, l'eau qui surgit pour former le courant de Humboldt est l'eau qui a circulé autour de l'Antarctique. Il était froid et avait une solubilité élevée pour le CO2 dans l'interface océan-atmosphère. L'eau de l'océan qui coule aux pôles arrive finalement à la surface où elle est réchauffée, éliminant ainsi une partie du CO2 absorbé dans l'Antarctique et l'Arctique.
Le courant de Humboldt, une grande zone de remontée des eaux océaniques au large des côtes du Chili et du Pérou, a l'un des pH les plus bas que l'on trouve naturellement dans les océans. (Voir la figure 4[35]) Le pH de cette eau de mer est de 7,7 à 7,88[36]. Si le pH moyen de l'océan est maintenant de 8,1, l'eau dans le courant de Humboldt est déjà à un pH inférieur à celui prévu par 2100. Les remontées d’eaux ont tendance à avoir des PH plus faibles que d'autres zones de l'océan pour deux raisons. Tout d'abord, l'eau a été à une profondeur où demeurent des organismes marins qui meurent et se décomposent en éléments nutritifs, tendant à réduire le pH. Deuxièmement, l'eau qui surgit pour former le courant de Humboldt est l'eau qui a circulé autour de l'Antarctique. Il était froid et avait une solubilité élevée pour le CO2 dans l'interface océan-atmosphère. L'eau de l'océan qui coule aux pôles arrive finalement à la surface où elle est réchauffée, éliminant ainsi une partie du CO2 absorbé dans l'Antarctique et l'Arctique.
Malgré son faible pH, les eaux de renfort du courant de Humboldt produisent 20 % de la capture de poissons sauvages dans le monde, qui se compose en grande partie d'anchois, de sardines et de maquereaux.[37] La base de la chaîne alimentaire comprend de grandes fleurs de coccolithophores, un phytoplancton calcifiant qui produit des plaques de carbonate de calcium symétriques pour se protéger des prédateurs. Les falaises blanches de Douvre sont composées de coquilles de coccolithophores. Pour citer l'un des articles les plus approfondis sur le sujet, «ces signatures de pH spécifiques au biome révèlent les niveaux actuels d'exposition au CO2 dissous élevé et faible, démontrant souvent que les organismes résidents connaissent déjà des régimes de pH qui ne sont pas prévus avant 2100 »[38]. Les auteurs remarquent:« L'effet de l'acidification des océans (OA) sur le biote marin est au mieux presque prévisible»[39]. Il est rafraîchissant de lire une opinion qu’il n'est pas si certain de prédire l'avenir d'un écosystème aussi complexe que les océans du monde.
Des scientifiques travaillant dans des instituts océanographiques au Royaume-Uni et en Allemagne ont publié un document en 2015 qui a exploré la possibilité que l'astéroïde qui a frappé la Terre il y a 65 millions d'années a provoqué une acidification des océans.
Parallèlement à l'extinction des dinosaures terrestres et marins, 100% des ammonites et 90% des coccolithophores, toutes deux espèces calcifiantes, se sont éteintes. L'étude a examiné la possibilité que 6 500 Gt (milliards de tonnes) de carbone en tant que CO2 soient produits par la vaporisation de la roche carbonée et les feux de forêt en raison de cet impact. Les auteurs ont conclu: "Nos résultats suggèrent que l'acidification n'était probablement pas la cause des extinctions"[40].
Six mille cinq cent Gt est l'équivalent de 650 ans d'émissions de CO2 au taux global actuel d'environ 10 Gt de carbone en CO2 par an. Étant donné que la concentration atmosphérique de CO2 était d'environ 1 000 ppm au moment de l'impact, l'addition de 6.500 Gt de carbone comme CO2 aurait augmenté la concentration à environ 4.170, soit environ 10 fois plus élevée qu'en 2015 et environ cinq fois plus élevée qu'elle peut être en 2100.
6- LA CAPACITÉ CALCIFIANTE DES ESPÈCES POUR CONTRÔLER LA BIOCHIMIE AU SITE DE CALCIFICATION
Tous les organismes sont capables de contrôler la chimie de leurs organes internes et leurs processus biochimiques. Le terme «homéostasie» signifie qu'un organisme peut maintenir en son sein un état souhaitable de chimie, de température, etc... dans une gamme de conditions extérieures.[41] Ceci est particulièrement nécessaire dans un milieu marin car la salinité de l'océan est trop élevée pour permettre les processus métaboliques qui ont lieu dans un organisme. Le terme général pour une partie importante de l'homéostasie est l'osmorégulation. Il existe deux stratégies biologiques pour l'accomplir. Les osmorégulateurs, qui incluent la plupart des poissons, maintiennent leur salinité interne à un niveau différent de leur environnement. Cela nécessite de l'énergie pour contrer la pression osmotique naturelle qui tend à égaliser la salinité interne d'un organisme avec la salinité de l'eau qu'il habite. Les osmoconformateurs, qui comprennent la plupart des espèces d’invertébrés, maintiennent leur teneur en sel à la même pression osmotique que leur environnement, mais ils modifient la composition des sels eux-mêmes par rapport à leur environnement.[42]
Les osmorégulateurs sont mieux illustrés par les exemples de poissons d'eau douce, de poissons d'eau de mer et de poissons capables de vivre dans l'eau douce et l'eau salée. Les poissons d'eau douce doivent être en mesure de conserver les sels dans leur corps afin de pouvoir repousser et expulser de l'eau douce et récupérer les sels de leurs reins avant l'excrétion. Les poissons d'eau de mer peuvent conserver l'eau tout en éliminant les sels à travers leurs branchies. Les poissons comme le saumon et les anguilles, qui passent une partie de leur vie dans de l'eau douce et une partie dans l'eau salée, peuvent transformer leurs fonctions corporelles lorsqu'elles passent d'un environnement à l'autre.[43]
Les osmoconformateurs économisent de l'énergie en maintenant une concentration en sel égale à leur environnement, mais, tout comme les osmorgulateurs, ils modifient la composition du mélange de sel pour permettre à des fonctions biologiques critiques de se produire en leur sein. Certains osmoconformateurs, tels que les étoiles de mer et les oursins, ne peuvent tolérer une gamme étroite de salinité externe, tandis que d'autres, comme les moules et les palourdes, peuvent s’isoler de l'environnement en fermant leurs coquilles et peuvent tolérer un large éventail de salinités externes[44].
L’osmorégulation est un bon exemple de la façon dont les espèces sont capables de s'adapter à des environnements qui autrement seraient hostiles à la vie. La calcification contrôlée est une autre fonction biologique qui dépend de la capacité de l'espèce à modifier et à contrôler sa chimie interne.
Le discours sur l'acidification des océans repose presque entièrement sur la chimie de l'eau de mer et la chimie du calcium et du dioxyde de carbone. Il est vrai que la coquille d'un organisme mort se dissolvera progressivement dans l'eau avec un pH abaissé[45]; cependant, on ne peut en déduire directement que la coquille, la carapace ou la structure corallienne d'une espèce se dissolvent sous un pH similaire alors que l'organisme est vivant. Même si une certaine dissolution se produit, tant que l'organisme construit du carbonate de calcium plus vite qu'il ne se dissout, la coque augmentera. Si ce n'était pas le cas, il serait impossible, pour la Mulette des canards, Anodonta anatina, de survivre dans une expérience de laboratoire à pH 3,0 pendant 10 jours sans perte de coquille importante[46]. C'est un exemple extrême, car il se trouve en dehors des conditions naturelles. Il est cependant bien établi que la croissance de la calcification dans les eaux douces de moules et de palourdes se situe à pH 6,0, dans la gamme de l'acidité réelle. La Moule Perlière de Louisiane, Margaritifera hembeli, est réellement limitée aux eaux avec un pH de 6,0 à 6,9. En d'autres termes, elle a besoin d'eau acide pour survivre[47]. Cela ne signifie pas que toutes les espèces marines qui calcifient tolèrent un pH de 6.0, mais seulement qu'il existe des organismes qui peuvent se calcifier à un pH beaucoup plus faible que ce qui se trouve dans les eaux océaniques aujourd'hui ou qui sont projetés, même dans des scénarios extrêmes.
Les coccolithophores représentent environ 50 % de la production de carbonate de calcium dans les océans ouverts. Une étude de laboratoire a révélé que "les espèces de coccolithophore Emiliania huxleyi sont significativement favorisées par des pressions partielles élevées de CO2", que "au cours des 220 dernières années, il y a eu une augmentation de 40% de la masse moyenne de coccolite" et que "dans un scénario où la prsession partielle de CO2 des océans du monde augmentent à 750 ppmv, les coccolithophores doubleront leur taux de calcification et de photosynthèse"[48]. Ce sont de bonnes nouvelles pour la production primaire et la production halieutique de l'océan dans la chaîne alimentaire. Cela démontre que des niveaux plus élevés de CO2 augmenteront non seulement la productivité des plantes, tant terrestres qu’aquatiques, mais stimuleront également la productivité d'une espèce, sinon la plus importante, des espèces calcifiantes dans les océans.
La raison pour laquelle les organismes marins calcifiants peuvent se calcifier sous une gamme plus large de valeurs de pH que l'on pourrait s'attendre par un calcul chimique simple, c'est qu'ils peuvent contrôler leur chimie interne sur le site de calcification. Les promoteurs de l'acidification dangereuse des océans ne le prennent pas en compte. Si la biologie interne des organismes était strictement déterminée par l'environnement chimique autour d'eux, il est peu probable qu'il y aurait une vie sur terre.
Comme mentionné précédemment, c'est au début de la période cambrienne, il y a environ 540 millions d'années, que les espèces marines d'invertébrés ont vu évoluer leur capacité de contrôler la cristallisation du carbonate de calcium comme armure pour se protéger contre les prédateurs. L'hypothèse est que cette capacité découle d'une capacité antérieure de longue date à empêcher la cristallisation spontanée du carbonate de calcium de protéger les processus métaboliques essentiels. Étonnamment, le dénominateur commun dans l'histoire anti-calcification-calcification est le mucus, souvent appelé «mucosité» [49].
L'extrait du document cité ci-dessus résume bien cette hypothèse:
L'apparition soudaine de squelettes calcifiés parmi de nombreux taux d'invertébrés différents à la transition précambrienne du Cambrien peut avoir nécessité une réorganisation mineure des fonctions de sécrétion préexistantes. En particulier, les caractéristiques de la matrice organique squelettique responsable de la régulation de la croissance des cristaux par inhibition peuvent être dérivées des excrétions épithéliales de mucus. Ce dernier aurait empêché le carbonatage de calcium spontané sur les tissus mous exposés à l'océan protérozoïque tardif hautement sursaturé ..., une fonction putative pour laquelle nous proposons le terme «anticalcification». Nous avons testé cette hypothèse en comparant les propriétés sérologiques des matrices squelettiques solubles dans l'eau et les excrétions de mucus de trois invertébrés - le scleractinien de corail Galaxeafascicularis et les mollusques bivalves Mytilus edulis et Mercenaria mercenaria. Les activités de croisement enregistrées entre muci et les matrices squelettiques solubles dans l'eau suggèrent que ces différents produits de sécrétion ont un degré élevé d'homologie. En outre, on a découvert que les muci fraîchement extraits de Mytilus inhibaient la précipitation du carbonate de calcium en solution[50].
Les auteurs ont constaté que les muci produits par un corail, une moule et une palourde étaient chimiquement très similaires, ce qui indiquait l'héritage d'un ancêtre commun au début du précambrien. Le mucus produit par les invertébrés a un certain nombre de fonctions connues. Il aide à la mobilité, agit comme un obstacle à la maladie et aux prédateurs, contribue à l'alimentation, agit comme un dispositif d'homing et prévient la dessiccation[51]. Les auteurs postulent que le mucus est également au centre du processus de calcification. Ceci explique comment la chimie, sur le site de calcification, peut être isolée de la chimie de l'eau de mer. La calcification peut se produire dans et sous la couche de mucus où l'organisme peut contrôler la chimie.
La croissance de la coquille nécessite un certain nombre de processus biochimiques. La concentration des ions calcium est intensifiée par les pompes ioniques dans l'espace extrapallial, ce qui permet une cristallisation. Le processus de calcification se produit à l’emplacement de la lèvre de la coquille qui provoqie l’accroissement de la coquille. La concentration des ions calcium est intensifiée par les pompes ioniques dans l'espace extracellulaire, ce qui permet une cristallisation. Le mucus, dans cet espace, contient des hormones qui dirigent le schéma du dépôt de cristaux de carbonate de calcium pour aboutir à une couche lisse de nouvelle coque. Il s'agit d'un cas classique d'un organisme contrôlant la biochimie en son sein, malgré les fluctuations de l'environnement extérieur qui n'autoriseraient pas de telles fonctions sophistiquées[52].
es références ci-dessus précisent que les espèces qui calcifient ont un degré élevé de sophistication dans le contrôle du processus de calcification. L'implication claire est que la calcification peut être réalisée avec succès malgré une gamme variée de conditions environnementales qui gêneraient ou arrêteraient le processus s'il n'était pas contrôlé. Cela ne semble pas avoir été considéré par la plupart ni par tous les auteurs qui proposent que l'acidification des océans exterminera une grande partie des espèces calcifiant en quelques décennies.
Une grande partie de la préoccupation concernant l'acidification des océans dans la littérature se concentre sur la chimie des carbonates. Lorsque le pH de l'eau de mer diminue, l'ion bicarbonate (HCO3) devient plus abondant alors que l'ion carbonate (CO3) devient moins abondant. On s'attend à ce qu'il soit plus difficile pour les espèces calcifiant d'obtenir le CO3 requis pour la calcification. Il ne semble pas être considéré que les espèces calcifiantes puissent être capables de convertir HCO3 en CO3.
Il y a très peu de références aux articles de revues après 1996 qui étudient les processus biochimiques impliqués dans la calcification. Le document cité plus haut par Marin et al. est l'enquête et la discussion les plus approfondies trouvé sur le sujet. Pourtant, il existe des centaines, sinon des milliers, d'articles qui prédisent les conséquences désastreuses de l'acidification des océans au cours de ce siècle.
Une étude récente publiée dans les Actes de l'Académie Nationale des Sciences met l'accent sur la façon dont les récifs coralliens résistants se modifient en fonction du pH de l'océan. Une étude de cinq ans sur les récifs coralliens des Bermudes montre que, lors des poussées de croissance et de calcification, l'eau de mer autour du récif subit une réduction rapide du pH[53]. Cette réduction du pH ne provoque manifestement pas de réaction négative du récif, car il est associé à une croissance rapide. L'étude a révélé que la raison pour laquelle le pH a chuté pendant les poussées de croissance est due au CO2 émis par le récif en raison de la respiration accrue. Il a été déterminé que les poussées de croissance étaient le résultat de floraisons au large du phytoplancton dérivant dans le récif et fournissant un approvisionnement alimentaire abondant pour les polypes des récifs. La conclusion de l'étude est que la croissance des coraux peut augmenter même si la croissance elle-même entraîne une réduction du pH de l'eau de mer environnante. Un résumé de l'étude dans New Scientist a conclu: « Ces coraux ne semblent pas influencés par les fluctuations de l'acidité locale qu'ils ont créées, qui étaient beaucoup plus importantes que celles que nous attendions des changements climatiques. Cela peut signifier que les coraux sont bien équipés pour faire face aux niveaux de pH plus basiques »[54]. Il ressort de la discussion ci-dessus que cela est probablement dû au fait que les polypes coralliens peuvent contrôler leur propre pH interne malgré la diminution du pH dans leur environnement.
7- UN OCÉAN PLUS CHAUD PEUT RÉ-ÉMETTRE LE CO2 VERS L'ATMOSPHÈRE
Alors que l'atmosphère d'aujourd'hui contient environ 850 Gt de carbone comme CO2, les océans contiennent 38.000 Gt de carbone, soit près de 45 fois plus que l'atmosphère. L'océan absorbe ou émet du CO2 dans l'interface océan-atmosphère, en fonction des concentrations de CO2 dans l'atmosphère et de la mer, de la salinité et de la température de la mer. Aux pôles, où l'eau de mer est la plus froide et la plus dense et a la plus grande solubilité pour le CO2, l'eau de mer s'enfonce dans les profondeurs, en évacuant du CO2. Dans les régions d'affermissement des eaux profondes telles que les côtes du Pérou, de la Californie, de l'Afrique de l'Ouest et de l'océan au nord de l'Inde, l'eau de mer riche en CO2 fertilise les fleurs de plancton qui alimentent de grandes pêcheries. Le phytoplancton près de la surface consomme une partie du CO2, et certains sont dégagés dans l'atmosphère.
Comme nous l'avons mentionné ci-dessus, nous n'avons pas la capacité de déterminer la quantité de CO2 absorbée par les océans ni la quantité qui est dégagée dans l'atmosphère ou l'effet net de ces phénomènes[55]. Le Groupe d'étude intergouvernemental sur le changement climatique (GIEC) reconnaît implicitement ce manque de connaissance quand il définit l'estimation de la rétroaction de CO2 sur l'intervalle exceptionnellement large de 25 à 225 ppmv K-1. Ce que nous savons, c'est que si les océans se réchauffent alors que les promoteurs du réchauffement climatique provoqué par l'homme disent qu'ils le feront, les océans tendront à libérer du CO2 dans l'atmosphère car l'eau de mer chaude à 30 ° C peut dissoudre seulement environ la moitié du CO2 que ne le fait une eau froide de mer à 0 ° C. Cela sera contrebalancé par la tendance à l'augmentation du CO2 atmosphérique afin d'entraîner une plus grande absorption de CO2 par les océans. Il ne semble pas que quiconque ait effectué le calcul de l'effet net de ces deux facteurs concurrents dans des circonstances variables.
8- RÉSUMÉ DES RÉSULTATS EXPÉRIMENTAUX SUR L'EFFET DE BAISSE DU PH RÉDUIT SUR LES ESPÈCES CALCIFIANTES
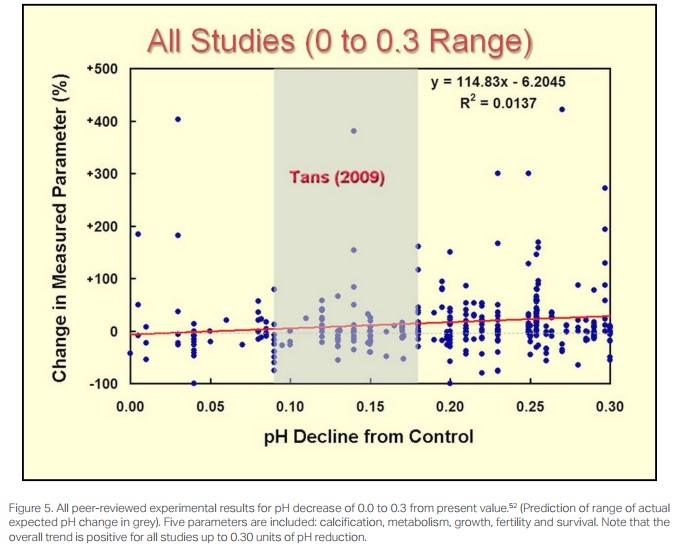 Dans son analyse approfondie et exhaustive des résultats expérimentaux évalués par des pairs sur l'effet de la réduction du pH sur cinq facteurs (calcification, métabolisme, croissance, fertilité et survie) chez les espèces calcifiantes marines, Craig Idso du site Web Science CO2 offre une vision surprenante. À partir de 1.103 résultats d'une large gamme d'études, les résultats sont réduits à ceux dans une réduction de 0,0 à 0,3 d’unités de pH[56]. Une étude de ces nombreuses études, qui utilisent l'observation directe des paramètres mesurés, indique que l'ensemble l'effet prévu de l'augmentation du CO2 sur les espèces marines serait positif plutôt que négatif (voir la figure 5[57]). Cela renforce encore le fait que le CO2 est essentiel à la vie, que le CO2 est à une faible concentration historique pendant cette période de glace du Pléistocène et que plus de CO2 plutôt que de moins serait généralement bénéfique pour la vie sur terre.
Dans son analyse approfondie et exhaustive des résultats expérimentaux évalués par des pairs sur l'effet de la réduction du pH sur cinq facteurs (calcification, métabolisme, croissance, fertilité et survie) chez les espèces calcifiantes marines, Craig Idso du site Web Science CO2 offre une vision surprenante. À partir de 1.103 résultats d'une large gamme d'études, les résultats sont réduits à ceux dans une réduction de 0,0 à 0,3 d’unités de pH[56]. Une étude de ces nombreuses études, qui utilisent l'observation directe des paramètres mesurés, indique que l'ensemble l'effet prévu de l'augmentation du CO2 sur les espèces marines serait positif plutôt que négatif (voir la figure 5[57]). Cela renforce encore le fait que le CO2 est essentiel à la vie, que le CO2 est à une faible concentration historique pendant cette période de glace du Pléistocène et que plus de CO2 plutôt que de moins serait généralement bénéfique pour la vie sur terre.
9- CONCLUSION
Il n'existe aucune preuve solide selon laquelle l'acidification des océans est une menace grave pour les espèces marines que de nombreux chercheurs ont affirmé. L'ensemble de la prémisse repose sur l'hypothèse de ce que le pH moyen des océans était il y a 265 ans, alors qu'il n'était pas possible de mesurer le pH, sans se soucier de tous les océans du monde. Les expériences de laboratoire dans lesquelles le pH a été maintenu dans une fourchette susceptible de se produire au cours de ce siècle montrent un léger effet positif sur cinq facteurs critiques: la calcification, le métabolisme, la croissance, la fertilité et la survie.
Le plus important est le fait que ceux qui soulèvent l'altération de l'acidification des océans ne tiennent pas compte de la capacité des espèces vivantes à s'adapter à une gamme de conditions environnementales. C'est l'un des personnages fondamentaux de la vie elle-même.
10- BIBLIOGRAPHIE[58]
 [1] Le Dr Patrick Moore est président du programme Énergie, écologie et prospérité du Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy »). Il a été un chef de file dans le domaine de l'environnement international depuis plus de 40 ans. Le Dr Moore est co-fondateur de Greenpeace et a servi pendant neuf ans comme président de Greenpeace Canada et sept ans à titre de directeur de Greenpeace International. Après avoir passé son temps avec Greenpeace, le Dr Moore a rejoint l'Alliance Forestière de la Colombie-Britannique, où il a travaillé pendant dix ans pour élaborer les principes de la foresterie durable qui ont été adoptés par une grande partie de l'industrie. Aujourd'hui, le Dr Moore se concentre sur la promotion de la durabilité et la concertation entre les préoccupations concurrentes. En 2013, il a publié «Confessions d’un transfuge de Greenpeace - La fabrication d’un environementaliste sensé »[1], qui documente ses 15 ans avec Greenpeace et expose sa vision d'un avenir durable.
[1] Le Dr Patrick Moore est président du programme Énergie, écologie et prospérité du Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy »). Il a été un chef de file dans le domaine de l'environnement international depuis plus de 40 ans. Le Dr Moore est co-fondateur de Greenpeace et a servi pendant neuf ans comme président de Greenpeace Canada et sept ans à titre de directeur de Greenpeace International. Après avoir passé son temps avec Greenpeace, le Dr Moore a rejoint l'Alliance Forestière de la Colombie-Britannique, où il a travaillé pendant dix ans pour élaborer les principes de la foresterie durable qui ont été adoptés par une grande partie de l'industrie. Aujourd'hui, le Dr Moore se concentre sur la promotion de la durabilité et la concertation entre les préoccupations concurrentes. En 2013, il a publié «Confessions d’un transfuge de Greenpeace - La fabrication d’un environementaliste sensé »[1], qui documente ses 15 ans avec Greenpeace et expose sa vision d'un avenir durable.
[2] Renseignements et informations médias: Deb Solberg-Tél: (403) 919-9335 - Demandes de développement: Samantha Leclerc -Tél: (403) 400-6862
Avertissement: Les opinions exprimées dans ce document sont exclusivement celles des auteurs indépendants et ne reflètent pas les opinions du Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy »), son conseil d'administration, son personnel et / ou ses donateurs.
ISSN # 1491-78 © 2015
Les recherches menées par le Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy ») sont menées selon les normes éthiques et académiques les plus élevées. Les sujets de recherche sont déterminés dans le cadre d'un sondage permanent sur les besoins des décideurs du secteur privé et du secteur public. La recherche est menée indépendamment des donateurs et du conseil d'administration du Centre Exploratoire et fait l'objet d'un double examen anonyme par des pairs avant la publication.
[3] À PROPOS DU Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy »)
Le Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy ») est un organisme de bienfaisance innovant en recherche et en éducation enregistré au Canada et aux États-Unis.
Fondé en 1999 par des fondations philanthropiques visant à aider les électeurs et les décideurs à améliorer leur compréhension de l'économie et des politiques publiques, notre mission est de développer les idées qui changent le monde.
Une pensée novatrice, inspirée de façon audacieuse. Rigoureusement recherché par les experts les plus crédibles dans leur domaine. Examen approfondi par les pairs. Une communication claire et pugnace aux électeurs et aux décideurs à travers la presse et le dialogue citoyen. C'est ainsi que le Centre Exploratoire pour les Politiques Publiques (« Frontier Centre for Public Policy ») atteint sa mission.
[4] Ken Caldeira and Michael E. Wickett, “Anthropogenic carbon and ocean pH,” Nature 425 (6956) (2003): 365-365
[5] Ross McKitrick, “HAC-Robust Measurement of the Duration of a Trendless Subsample in a Global Climate Time Series.” Open Journal of Statistics 4, no. 7 (2014): 527-535. doi: 10.4236/ojs.2014.47050.
[6] Carles Pelejero, Eva Calvo and Ove Hoegh-Guldberg, “Paleo-perspectives on ocean acidification,” Trends in Ecology and Evolution 25, no. 6 (2010): 332- 344.
[7] Ibid.
[8] Ibid.
[9] Le Natural Resources Defense Council (anglais : Conseil de défense des ressources naturelles) ou NRDC est une organisation non gouvernementale américaine active dans le domaine de la protection de l'environnement. Fondé en 1970, l'organisme basé à New York regroupe 1,2 millionde membres et emploie plus de 300 personnes dans ses bureaux de Washington, San Francisco, Los Angeles, Chicago et Pékin.
[10] Natural Resources Defense Council, “Ocean Acidification: The Other CO2 Problem,” August 2009. https://www.nrdc.org/oceans/acidification/files/NRDCOceanAcidFSWeb.pdf.
[11] M.M. Helm, “Cultured Aquatic Species Information Programme: Crassostrea gigas,” Food and Agriculture Organization of the United Nations, Fisheries and Aquaculture Department. http://www.fao.org/fishery/culturedspecies/Crassostrea_gigas/en#tcNA0089.
[12] John Pickrell, “Oceans Found to Absorb Half of All Man-Made Carbon Dioxide,” National Geographic News, July 15, 2004. http://news.nationalgeographic. com/news/2004/07/0715_040715_oceancarbon.html.
[13] N.R. Bates et al., “Detecting anthropogenic carbon dioxide uptake and ocean acidification in the North Atlantic Ocean,” Biogeosciences 9, no. 7 (2012): 2509-2522, doi:10.5194/bg-9-2509-2012.
[14] P. Peylin et al., “Global atmospheric carbon budget: results from an ensemble of atmospheric CO2 inversions,” Biogeosciences 10, no. 10 (2013): 6699- 6720. doi:10.5194/bg-10-6699-2013, quoting R. Wanninkhof et al., “Global ocean carbon uptake: magnitude, variability and trends,” Biogeosciences 10 (1983-2000, 2013). doi: 10.5194/bg- 10-1983-2013.
[15] R.J. Donohue et al., “Impact of CO2 fertilization on maximum foliage cover across the globe’s warm, arid environments,” Geophysical Research Letters 40, no. 12 (2013): 3031-3035. doi:10.1002/grl.50563; Smithsonian Institution, “Forests are growing faster, ecologists discover; Climate change appears to be driving accelerated growth,” ScienceDaily, February 2, 2010. http://www.sciencedaily.com/releases/2010/02/100201171641.htm#citation_apa; Hans Pretzsch et al., “Forest stand growth dynamics in Central Europe have accelerated since 1870,” Nature Communications 5 (4967) (2014). doi: 10.1038/ ncomms5967.
[16] See, for example, World Wildlife Fund, “Living Blue Planet Report: Species, Habitats and Human Well-being,” edited by J. Tanzer, C. Phua, A. Lawrence, A. Gonzales, T. Roxburgh and P. Gamblin (Gland, Switzerland, 2015).
[17] Steve Weiner and Patricia M. Dove, “An Overview of Biomineralization Processes and the Problem of the Vital Effect,” Reviews in Mineralogy and Geochemistry 54, no. 1 (2003): 1-29.
[18] “The Cambrian Period (544-505 mya),” Virtual Fossil Museum. http://www.fossilmuseum.net/Paleobiology/Paleozoic_paleobiology.htm.
[19] Nasif Nahle, “Cycles of Global Climate Change,” Biology Cabinet, July 2009, accessed November 13, 2015, http://www.biocab.org/carbon_dioxide_geological_timescale.html; C.R. Scotese, Analysis of the Temperature Oscillations in Geological Eras, 2002; W.F. Ruddiman, Earth’s Climate: past and future (New York, NY: W. H. Freeman, 2001); Mark Pagani, et al., “Marked Decline in Atmospheric Carbon Dioxide Concentrations During the Paleocene,” Science 309, no. 5734 (2005): 600-603.
[20] JoNova, The 800 year lag in CO2 after temperature – graphed. http://joannenova.com.au/global-warming-2/ice-core-graph/
[21] 7 Jeroen Boeye, Justin M.J. Travis, Robby Stoks and Dries Bonte, “More rapid climate change promotes evolutionary rescue through selection for increased dispersal distance,” Evolutionary Applications 6, no. 2 (2013): 353-364. doi: 10.1111/eva.12004.
[22] Stephen Jay Gould, Wonderful Life: The Burgess Shale and the Nature of History (W.W. Norton and Company, 1989).
[23] Trevor D. Price, Anna Qvarnström and Darren E. Irwin, “The role of phenotypic plasticity in driving genetic evolution,” Proceedings of the Royal Society B: Biological Sciences 270, no. 1523 (2003): 1433-1440. doi:10.1098/rspb.2003.2372.
[24] Eva Jablonka and Gal Raz, “Transgenerational Epigenetic Inheritance: Prevalence, Mechanisms, and Implications for the Study of Heredity and Evolution,” Quarterly Review of Biology 84, no. 2 (2009): 131-176.
[25] Christopher S. Murray, Alex Malvezzi, Christopher J. Gobler and Hannes Baumann, “Offspring sensitivity to ocean acidification changes seasonally in a coastal marine fish,” Marine Ecology Progress Series 504 (2014): 1-11.
[26] Ocean Health, Chemistry of Seawater. http://oceanplasma.org/documents/chemistry.html.
[27] R.E. Zeebe and D.A. Wolf-Gladrow, “Carbon Dioxide,
[28] L'Institut d'océanographie Scripps (en anglais Scripps Institution of Oceanography, SIO) est un centre de recherche scientifique maritime. Situé à La Jolla en Californie, il s'agit de l'un des plus anciens, des plus grands et des plus importants centres de recherche de son type au monde
[29] Ibid.
[29bis] Parmi la littérature, on peut citer le rapport du GIEC : "The AR4 assessment was virtually certain that rising atmospheric CO2 had changed carbonate chemistry of the ocean (i.e., buffering capacity, carbonate and bicarbonate concentrations), and that a decrease in surface pH of 0.1 had occurred over the global ocean (calculated from the uptake of anthropogenic CO2 between 1750 and 1994 ([Sabine et al., 2004; Raven et al., 2005]; AR4, 5.4.2.3, WGI Table 7.3)" (source WG2 AR5 chapter 30 p. 8/138). Il s'agit donc de calculs théoriques et non d'observations. L'IPCC pose cette affirmation de manière "virtually certain" c'est à dire, selon son échelle, avec une "probabilité supérieure à 99%" (source AR4- IPCC). Mais, curieusement, dans le même temps, la Wendy Schmidt Ocean Health a lancé un appel d'offre international pour "pour créer une technologie de capteur de pH" en partant du constat que "les technologies de capteurs de pH les plus récentes sont trop coûteuses, imprécises ou instables pour permettre une connaissance suffisante de l'état de l'acidification des océans" (source: whatsupwiththat)
[30] R.E. Zeebe, “History of Seawater Carbonate Chemistry, Atmospheri-AR5c CO2 , and Ocean Acidification,” Annual Review of Earth and Planetary Science 40 (2012): 141-165. doi:10.1146/annurev-earth-042711-105521; National Oceanic and Atmospheric Administration, “Ocean Acidification in the Pacific Northwest,” May 2014. http://www.noaa.gov/factsheets/OA18PNWFacts14V4.pdf.
[31] H.U. Sverdrup, Martin W. Johnson and Richard H. Fleming, The Oceans, Their Physics, Chemistry, and General Biology (New York: Prentice-Hall, 1942). http:// ark.cdlib.org/ark:/13030/kt167nb66r/
[32] C.E. Pelejero, E. Calvo, M.T. McCulloch, J.F. Marshall, M.K. Gagan, J.M. Lough and B.N. Opdyke, “Preindustrial to Modern Interdecadal Variability in Coral Reef pH,” Science 309 (2005): 2204-2207.
[33] U.S. House Committee on Natural Resources, CEQ Draft Guidance for GHG Emissions and the Effects of Climate Change, Testimony of Prof. John R. Christy, University of Alabama in Huntsville, May 13, 2015. http://docs.house.gov/meetings/II/II00/20150513/103524/HHRG-114-II00-Wstate-ChristyJ-20150513. pdf.
[34] G.E. Hofmann et al., “High-Frequency Dynamics of Ocean pH: A Multi-Ecosystem Comparison,” PLoS ONE 6, no. 12 (2011): e28983. doi: 10.1371/journal. pone.0028983
[35] Scott C. Doney, “The Dangers of Ocean Acidification,” Scientific American, March 2006. http://www.precaution.org/lib/06/ocean_acidification_from_ c02_060301.pdf.
[36] Matthias Egger, “Ocean Acidification in the Humboldt Current System,” Master Thesis, Swiss Federal Institute of Technology, August 2011.
[37] J. Blanco et al., “Integrated Overview of the Oceanography and Environmental Variability of the Humboldt Current System,” Chile, IFOP-IMARPE-ONUDI, December 2002. http://humboldt.iwlearn.org/es/informacion-y-publicacion/Modulo1_PyVariabil_AmbientalVol1.pdf.
[38] G.E. Hofmann et al., “High-Frequency Dynamics of Ocean pH: A Multi-Ecosystem Comparison.”
[39] Ibid.
[40] Toby Tyrrell, Agostino Merico, and David I.A. McKay, “Severity of ocean acidification following the end-Cretaceous asteroid impact,” PNAS 112, no. 21 (2015): 6556-6561.
[41] J.M. Wood, “Bacterial Osmoregulation: A Paradigm for the Study of Cellular Homeostasis,” Annual Review of Microbiology 65 (2011): 215-238. doi: 10.1146/ annurev-micro-090110-102815.
[42] 7 Kenneth S. Saladin, “Osmoregulation,” Biology Encyclopedia Forum. http://www.biologyreference.com/Oc-Ph/Osmoregulation.html.
[43] American Museum of Natural History, “Surviving in Salt Water.” http://www.amnh.org/exhibitions/past-exhibitions/water-h2o-life/life-in-water/surviving-insalt-water.
[44] Marion McClary, “Osmoconformer,” Encyclopedia of the Earth, June 20, 2014. http://www.eoearth.org/view/article/155074/.
[45] National Oceanic and Atmospheric Administration, “What is Ocean Acidification?” PMEL Carbon Program. http://www.pmel.noaa.gov/co2/story/ What+is+Ocean+Acidification%3F.
[46] T.P. Mäkelä and A.O.J. Oikari, “The Effects of Low Water pH on the Ionic Balance in Freshwater Mussel Anodonta anatina L,” Ann. Zool. Fenici 29 (December 1992): 169-175. http://www.sekj.org/PDF/anzf29/anz29-169-175.pdf.
[47] 2 Wendell R. Haag, North American Freshwater Mussels: Natural History, Ecology, and Conservation (Cambridge: Cambridge University Press, 2012).
[48] M.D. Iglesias-Rodriguez et al., “Phytoplankton Calcification in a High-CO2 World,” Science 320, no. 5847 (2008): 336-340. http://www.sciencemag.org/ content/320/5874/336.full#F1.
[49] F. Marin et al., “Skeletal matrices, muci, and the origin of invertebrate calcification,” Proceedings of the National Academy of Sciences of the United State of America 93, no. 4 (1996): 1554-1559
[50] Ibid.
[51] M.W. Denny, “Invertebrate mucous secretions: functional alternatives to vertebrate paradigms,” Symposia of the Society for Experimental Biology 43 (1989): 337-366.
[52] Frédéric Marin and Gilles Luquet, “Molluscan shell proteins,” Comptes Rendus Palevol 3 (2004): 469-492. doi: 10.1016/j.crpv.2004.07.009.
[53] K.L. Yeakel et al., “Shifts in coral reef biogeochemistry and resulting acidification linked to offshore productivity,” PNAS (2015). http://www.pnas.org/content/ early/2015/11/04/1507021112.abstract.
[54] Michael Slezak, “Growing corals turn water more acidic without suffering damage,” New Scientist, November 9, 2015. https://www.newscientist.com/ article/dn28468-growing-corals-turn-water-more-acidic-without-suffering-damage/
[55] Renee Cho, “Solving the Mysteries of Carbon Dioxide,” State of the Planet, Earth Institute, Columbia University, July 30, 2014. http://blogs.ei.columbia. edu/2014/07/30/solving-the-mysteries-of-carbon-dioxide/.
[56] CO2 Science, “Ocean Acidification Database,” 2015. http://www.co2science.org/data/acidification/results.php. See also http://www.co2science.org/ subject/o/subject_o.php.
[57] Pieter Tans, “An accounting of the observed increase in oceanic and atmospheric CO2 and an outlook for the future,” Oceanography 22 (2009): 26-35
[58] BIBLIOGRAPHY
- American Museum of Natural History. “Surviving in Salt Water.” http://www.amnh.org/exhibitions/past-exhibitions/water-h2o-life/life-in-water/surviving-insalt-water.
- Bates, N.R., M.H.P. Best, K. Neely, R. Garley, A.G. Dickson and R.J. Johnson. “Detecting anthropogenic carbon dioxide uptake and ocean acidification in the North Atlantic Ocean.” Biogeosciences 9, no. 7 (2012): 2509-22. doi:10.5194/bg-9-2509-2012.
- Blanco, J., G. Daneri, R. Escribano, L. Guzmán, C. Morales, J. Osses, G. Pizarro, R. Quiñones, S.A. Rosales and R. Serra. “Integrated Overview of the Oceanography and Environmental Variability of the Humboldt Current System.” Chile, IFOP-IMARPE-ONUDI, December 2002. http://humboldt.iwlearn.org/ es/informacion-y-publicacion/Modulo1_PyVariabil_AmbientalVol1.pdf.
- Boeye, Jeroen, Justin M.J. Travis, Robby Stoks, Dries Bonte. “More rapid climate change promotes evolutionary rescue through selection for increased dispersal distance.” Evolutionary Applications 6, no. 2 (2013): 353-364. doi:10.1111/eva.12004.
- Caldeira, Ken and Michael E. Wickett. “Anthropogenic carbon and ocean pH.” Nature 425 (6956) (2003): 365-365.
- Cho, Renee. “Solving the Mysteries of Carbon Dioxide.” State of the Planet, Earth Institute, Columbia University, July 30, 2014. http://blogs.ei.columbia. edu/2014/07/30/solving-the-mysteries-of-carbon-dioxide/.
- CO2 Science. “Ocean Acidification Database.” 2015. http://www.co2science.org/data/acidification/results.php
- Denny, M.W. “Invertebrate mucous secretions: functional alternatives to vertebrate paradigms.” Symposia of the Society for Experimental Biology 43 (1989): 337-366.
- Doney, Scott C. “The Dangers of Ocean Acidification,” Scientific American, March 2006. http://www.precaution.org/lib/06/ocean_acidification_from_ c02_060301.pdf.
- Donohue, Randall J., Michael L. Roderick, Tim R. McVicar and Graham D. Farquhar. “Impact of CO2 fertilization on maximum foliage cover across the globe’s warm, arid environments.” Geophysical Research Letters 40, no. 12 (2013): 3031–3035. doi:10.1002/grl.50563.
- Egger, Matthias. “Ocean Acidification in the Humboldt Current System.” Master Thesis, Swiss Federal Institute of Technology, August 2011.
- Gould, Stephen Jay. Wonderful Life: The Burgess Shale and the Nature of History. (W.W. Norton and Company, 1989).
- Haag, Wendell R. North American Freshwater Mussels: Natural History, Ecology, and Conservation. Cambridge: Cambridge University Press, 2012.
- Helm, M.M. “Cultured Aquatic Species Information Programme: Crassostrea gigas.” Fisheries and Aquaculture Department. http://www.fao.org/fishery/ culturedspecies/Crassostrea_gigas/en#tcNA0089.
- Hofmann, G.E., J.E. Smith, K.S. Johnson, U. Send, L.A. Levin, F. Micheli, A. Paytan, N.N. Price, B. Peterson, Y. Takeshita, P.G. Matson, E.D. Crook, K.J. Kroeker, M.C. Gambi, E.B. Rivest, C.A. Frieder, P.C. Yu and T.R. Martz. “High-Frequency Dynamics of Ocean pH: A Multi-Ecosystem Comparison.” PLoS ONE 6, no. 12 (2011): e28983. doi:10.1371/journal.pone.0028983.
- Iglesias-Rodriguez, D., P.R. Halloran, R.E.M. Rickaby, I.R. Hall, E. Colmenero-Hidalgo, J.R. Gittins, D.R.H. Green, T. Tyrrell, S.J. Gibbs, P. von Dassow, E. Rehm, E.V. Armbrust, K.P. Boessenkool. “Phytoplankton Calcification in a High-CO2 World.” Science 320 (5874) (April 2008): 336-340. http://www.sciencemag.org/ content/320/5874/336.full#F1.
- Jablonka, Eva and Gal Raz. “Transgenerational Epigenetic Inheritance: Prevalence Mechanisms, and Implications for the Study of Heredity and Evolution.” Quarterly Review of Biology 84, no. 2 (2009): 131-176.
- JoNova, The 800 year lag in CO2 after temperature – graphed. http://joannenova.com.au/global-warming-2/ice-core-graph/
- Mäkelä, T.P. and A.O.J. Oikari. “The Effect of Low Water pH on the Ionic Balance in Freshwater Mussel Anadonta anatina L.” Ann. Zool. Fenici 29 (December 1992): 169-175. http://www.sekj.org/PDF/anzf29/anz29-169-175.pdf.
- Marin, F., M. Smith, Y. Isa, G. Muyzer, P. Westbroek. “Skeletal matrices, muci, and the origin of invertebrate calcification.” Proceedings of the National Academy of Sciences of the United States of America 93, no. 4 (1996): 1554-1559.
- Marin, Frédéric, and Gilles Luquet. “Molluscan shell proteins.” Comptes Rendus Palevol 3 (2004): 469-492. doi: 10.1016/j.crpv.2004.07.009.
- McKitrick, Ross. “HAC-Robust Measurement of the Duration of a Trendless Subsample in a Global Climate Time Series.” Open Journal of Statistics 4, no. 7 (2014): 527-535. doi: 10.4236/ojs.2014.47050. [26] FRONTIER CENTRE FOR PUBLIC POLICY
- McClary, Marion. “Osmoconformer.” Encyclopedia of the Earth, June 20, 2014. http://www.eoearth.org/view/article/155074/.
- Murray, Christopher S., Alex Malvezzi, Christopher J. Gobler and Hannes Baumann. “Offspring sensitivity to ocean acidification changes seasonally in a coastal marine fish.” Marine Ecology Progress Series 504 (2014): 1-11.
- Nahle, Nasif. “Cycles of Global Climate Change.” Biology Cabinet, July 2009. Accessed November 13, 2015. http://www.biocab.org/carbon_dioxide_geological_timescale.html.
- National Oceanic and Atmospheric Administration. “Ocean Acidification in the Pacific Northwest.” May 2014. http://www.noaa.gov/factsheets/ OA18PNWFacts14V4.pdf.
- National Oceanic and Atmospheric Administration. “What is Ocean Acidification?” PMEL Carbon Program. http://www.pmel.noaa.gov/co2/story/ What+is+Ocean+Acidification%3F.
- Natural Resources Defense Council. “Ocean Acidification: The Other CO2 Problem.” August 2009. https://www.nrdc.org/oceans/acidification/files/NRDCOceanAcidFSWeb.pdf.
- Ocean Health, Chemistry of Seawater. http://oceanplasma.org/documents/chemistry.html.
- Pelejero, C., E. Calvo, M.T. McCulloch, J.F. Marshall, M.K. Gagan, J.M. Lough and B.N. Opdyke. “Preindustrial to Modern Interdecadal Variability in Coral Reef pH.” Science 309 (2005): 2204-2207.
- Pelejero, Carles, Eva Calvo and Ove Hoegh-Guldberg. “Paleo-perspectives on ocean acidification.” Trends in Ecology and Evolution 25, no. 6 (2010): 332-344.
- Peylin, P., R.M. Law, K.R. Gurney, F. Chevallier, A.R. Jacobson, T. Maki, Y. Niwa, P.K. Patra, W. Peters, P.J. Rayner, C. Rödenbeck, I.T. van der Laan-Luijkx and X. Zhang. “Global atmospheric carbon budget: results from an ensemble of atmospheric CO2 inversions.” Biogeosciences 10, no. 10 (2013): 6699-720.
- Pickrell, John. “Oceans Found to Absorb Half of All Man-Made Carbon Dioxide.” National Geographic News, July 15, 2004. http://news.nationalgeographic. com/news/2004/07/0715_040715_oceancarbon.html.
- Pretzsch, Hans, Peter Biber, Gerhard Schütze, Enno Uhl, Thomas Rötzer. “Forest stand growth dynamics in Central Europe have accelerated since 1870.” Nature Communications 5 (4967) (2014). doi: 10.1038/ncomms5967.
- Price, Trevor D., Anna Qvarnström, Darren E. Irwin. “The role of phenotypic plasticity in driving genetic evolution.” Proceedings of the Royal Society B: Biological Sciences 270 (1523) (2003):1433-1440. doi:10.1098/rspb.2003.2372.
- Saladin, Kenneth S. “Osmoregulation.” Biology Encyclopedia Forum. http://www.biologyreference.com/Oc-Ph/Osmoregulation.html.
- Slezak, Michael. “Growing corals turn water more acidic without suffering damage.” New Scientist, November 9, 2015. https://www.newscientist.com/article/ dn28468-growing-corals-turn-water-more-acidic-without-suffering-damage/.
- Smithsonian Institution. “Forests are growing faster, ecologists discover; Climate change appears to be driving accelerated growth.” ScienceDaily, February 2, 2010. www.sciencedaily.com/releases/2010/02/100201171641.htm.
- Sverdrup, H.U., Martin W. Johnson and Richard H. Fleming. The Oceans, Their Physics, Chemistry, and General Biology. (New York: Prentice-Hall, 1942). http:// ark.cdlib.org/ark:/13030/kt167nb66r/.
- Tans, Pieter. “An accounting of the observed increase in oceanic and atmospheric CO2 and an outlook for the future.” Oceanography 22 (2009): 26-35.
- Tyrrell, Toby, Agostino Merico and David I.A. McKay. “Severity of ocean acidification following the end-Cretaceous asteroid impact.” Proceedings of the National Academy of Sciences of the United States of America 112, no. 21 (2015): 6556-6561.
- U.S. House Committee on Natural Resources, CEQ Draft Guidance for GHG Emissions and the Effects of Climate Change, Testimony of Prof. John R. Christy, University of Alabama in Huntsville, May 13, 2015. http://docs.house.gov/meetings/II/II00/20150513/103524/HHRG-114-II00-Wstate-ChristyJ-20150513. pdf.
- Virtual Fossil Museum. “The Cambrian Period (544-505 mya).” http://www.fossilmuseum.net/Paleobiology/Paleozoic_paleobiology.htm.
- Weiner, Steve and Patricia M. Dove. “An Overview of Biomineralization Processes and the Problem of the Vital Effect.” Reviews in Mineralogy and Geochemistry 54, no. 1 (2003): 1-29.
- Wood, J.M. “Bacterial Osmoregulation: A Paradigm for the Study of Cellular Homeostasis.” Annual Review of Microbiology 65 (2011): 215-238. doi: 10.1146/ annurev-micro-090110-102815. [27] FRONTIER CENTRE FOR PUBLIC POLICY
- World Wildlife Fund. “Living Blue Planet Report: Species, Habitats and Human Well-being.” Eds. J. Tanzer, C. Phua, A. Lawrence, A. Gonzales, T. Roxburgh and P. Gamblin. (Gland, Switzerland, 2015). Yeakel, Kiley L., Andreas J. Anderson, Nicholas R. Bates, Timothy J. Noyes, Andrew Collins, and Rebecca Garley. “Shifts in coral reef biogeochemistry and resulting acidification linked to offshore productivity.” PNAS (2015). http://www.pnas.org/content/early/2015/11/04/1507021112.abstract.
- Zeebe, R.E. “History of Seawater Carbonate Chemistry Atmospheric CO2 , and Ocean Acidification.” Annual Review of Earth and Planetary Science 40 (2012): 141-165. doi:10.1146/annurev-earth-042711-105521.
- Zeebe, R.E. and D.A. Wolf-Gladrow. “Carbon Dioxide, Dissolved (Ocean).” Encyclopedia of Paleoclimatology and Ancient Environments, ed. V. Gornitz. Kluwer Academic Publishers, Earth Science Series, 2008.